
Sequestrantes: função e importância nas formulações
Quando falamos em formulações de saneantes é muito comum abordarmos os ativos principais. Porém, além deles, algumas matérias-primas são de suma importância e fazem grande diferença nas formulações, como os sequestrantes que abordaremos neste artigo.
O que são sequestrantes?
Os sequestrantes, também conhecidos como agentes quelantes, são substâncias cujas moléculas possuem uma característica muito distinta, pois sua estrutura molecular apresenta uma peculiaridade: elas possuem uma estrutura com regiões que normalmente se assemelham a dentes ou garras.
Essa estrutura distinta, inclusive, é a responsável pelo nome quelante, oriundo da palavra grega chele, que significa garra.
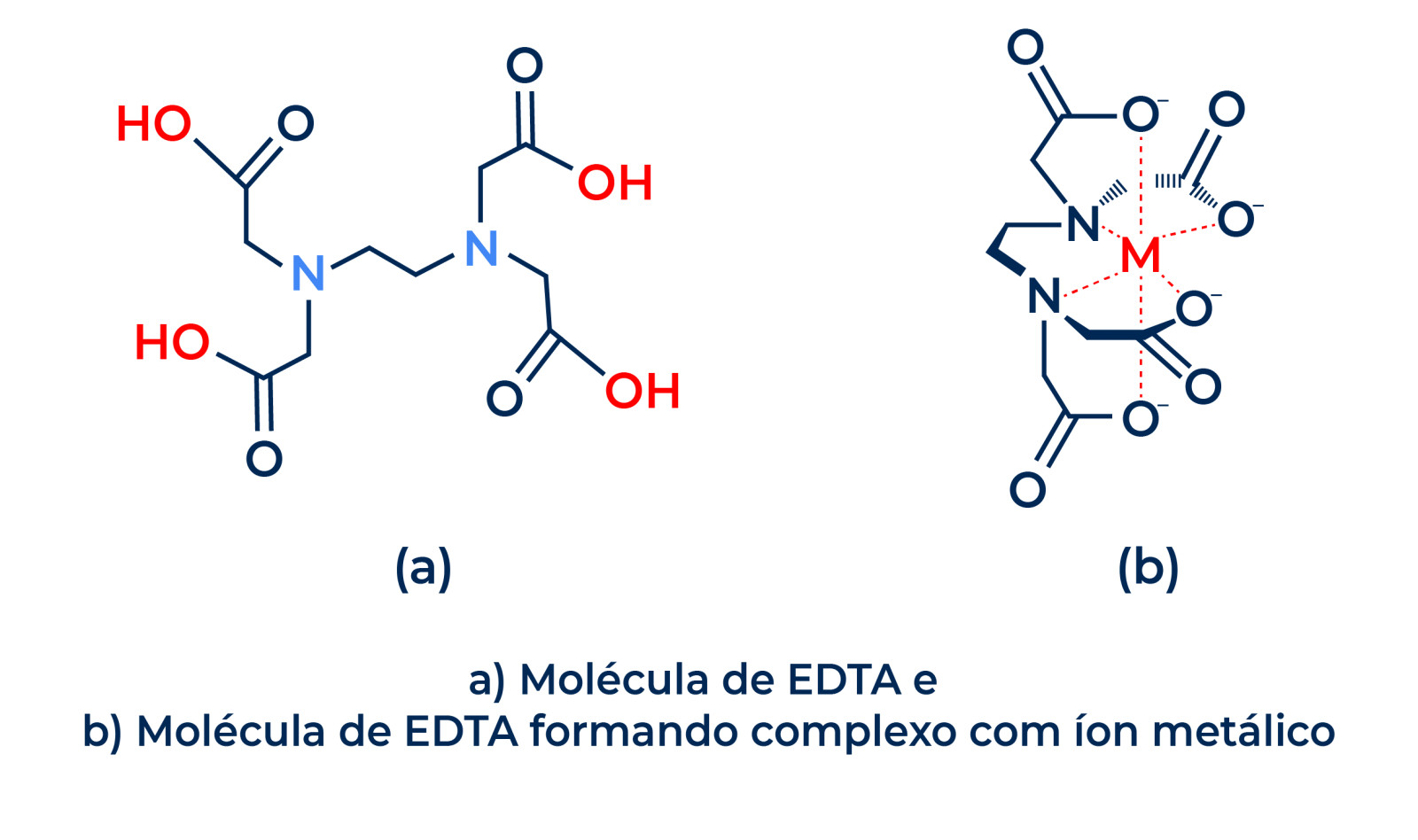
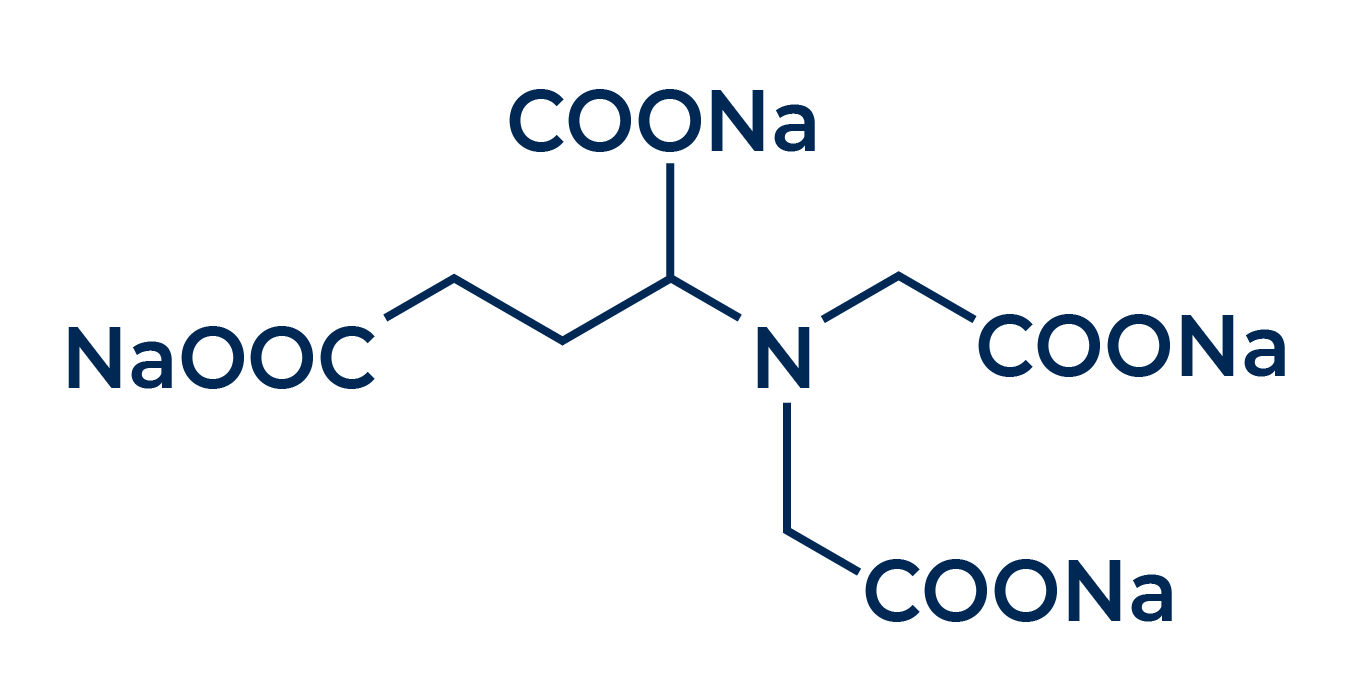
Vamos visualizar estas garras na estrutura de um famoso sequestrante, o EDTA. Abaixo, temos a estrutura da molécula deste sequestrante, com suas garras destacadas em vermelho:
.png)
Estas garras não são apenas visuais, mas também possuem uma habilidade única: conseguem “pinçar” ou “aprisionar” íons metálicos retirando-os do meio aquoso por um processo conhecido por complexação.
Indo para uma visão mais técnica, os sequestrantes são moléculas responsáveis pela formação de um complexo com estrutura em forma de anel pela conjugação por ligações covalentes dativas com íons metálicos, ou seja, são moléculas responsáveis por formar complexos com íons metálicos, sequestrando-os.
Essa capacidade de "aprisionar" os íons metálicos impede que eles interfiram com outros componentes da fórmula, garantindo a estabilidade, a eficácia e a segurança do produto final.
Dessa forma, em uma formulação de saneantes, os sequestrantes acabam sendo os responsáveis pela proteção do ativo, pois a água potável sempre conterá uma certa quantidade de íons metálicos dissolvidos, o que também é conhecido como a dureza da água.
Nas formulações com tensoativos catiônicos, os sequestrantes protegem o ativo sequestrando os íons da dureza da água, aumentando a eficácia para remover cátions importantes e necessários à atividade de membrana dos microrganismos.
Já nas formulações com tensoativos aniônicos, os sequestrantes aumentam o desempenho do ativo e melhoram atributos como a espumação.
Como os sequestrantes protegem o ativo catiônico?
Os ativos catiônicos, presentes em formulações de desinfetantes, por exemplo, são protegidos pelo sequestrantes de diferentes formas:
- Complexação de íons metálicos: os sequestrantes de íons se ligam aos íons metálicos presentes na água, sendo os principais o cálcio e o magnésio, formando complexos estáveis. Isso impede que os íons metálicos se liguem ao ativo catiônico do desinfetante, reduzindo sua eficácia. A redução dessa eficácia se deve ao fato de o ativo catiônico acabar “confundindo” os íons de cálcio e magnésio com a membrana dos microrganismos e “atacando” esses íons ao invés de fazer seu papel de atacar e eliminar o microrganismo.
- Prevenção da precipitação: os íons metálicos podem reagir com o ativo catiônico do desinfetante e formar precipitados insolúveis. Isso pode reduzir a concentração do ativo catiônico na solução e tornar o desinfetante menos eficaz. Os sequestrantes de íons se ligam aos íons metálicos e impedem que eles reajam com o ativo catiônico, evitando a formação de precipitados.
- Melhoria da estabilidade: os sequestrantes de íons podem ajudar a proteger o ativo catiônico da degradação por oxidação ou outras reações químicas. Isso pode melhorar a estabilidade do desinfetante e aumentar sua vida útil. Eles evitam que reações de oxidação dos metais ocorram em corantes e fragrâncias.
Como os sequestrantes protegem o ativo aniônico?
O uso de sequestrantes em regiões onde a dureza da água é alta é indispensável para garantir a qualidade e estabilidade do produto. O sequestrante impede que os íons Cálcio e Magnésio reajam com os tensoativos do detergente, protegendo-os e garantindo a espumação e estabilidade do produto, já que a água dura impacta diretamente na espumação, devido à presença de íons metálicos.
Esses íons reagem com os surfactantes do detergente, que são responsáveis pela formação da espuma, e formam precipitados insolúveis. Isso diminui a quantidade de surfactantes disponíveis para formar espuma, resultando em uma espuma menos abundante e mais fina.
Apesar de a quantidade de espuma não ser necessariamente um indicador da eficácia do detergente, ela é diretamente associada à falta de qualidade pelo consumidor, além disso, se o ativo estiver insolúvel ele não terá capacidade de limpeza
Exemplos de sequestrantes
Cada sequestrante possui características e aplicações específicas, sendo fundamental escolher o ideal para cada necessidade.
EDTA (Ácido Etilenodiaminotetracético)
Já apresentado anteriormente, o EDTA é um dos sequestrantes mais utilizados devido à sua alta eficiência e versatilidade, sendo capaz de se ligar a uma ampla gama de íons metálicos. Porém, também é um sequestrante muito seletivo, o que significa que pode se ligar a íons metálicos específicos sem se ligar a outros íons presentes na solução.
É eficaz na complexação de uma ampla gama de íons metálicos, incluindo: Cálcio, Magnésio, Ferro e Cobre. É relativamente barato e fácil de usar.

O EDTA sequestra íons metálicos através de um processo conhecido como quelação. A molécula do EDTA possui seis grupos doadores de elétrons: quatro grupos carboxílicos e dois grupos amina. Estes grupos doadores de elétrons se ligam aos íons metálicos, formando um complexo estável. A força da ligação entre o EDTA e o íon metálico depende da carga do íon metálico, do tamanho do íon metálico e da natureza dos grupos doadores de elétrons do EDTA.
O EDTA faz seu processo de quelação, “abraçando” o íon metálico e protegendo os demais componentes da formulação.
Apesar de ser um sequestrante muito utilizado, atualmente existem alguns pontos que devem ser pesados ao se optar pelo emprego do EDTA. Primeiramente, com relação aos impactos ambientais, tem-se que o EDTA não é uma substância biodegradável, um fato que pode gerar graves problemas pois sua presença no meio ambiente pode vir a empobrecer o solo e remover substâncias necessárias para a vida tanto em solo quanto na água.
Também não se deve negligenciar os riscos oferecidos por esta substância: em sua forma sólida, o EDTA é um pó que pode causar lesões oculares graves, além de ser um forte irritante das vias respiratórias e ser nocivo em caso de ingestão. Sua forma diluída elimina os riscos de irritação das vias respiratórias, mas mantém os demais problemas.
Esse conjunto de características gerou uma força motriz para que se buscasse o desenvolvimento e emprego de sequestrantes alternativos ao EDTA, especialmente visando o combate ao dano ambiental que esta substância é capaz de causar.
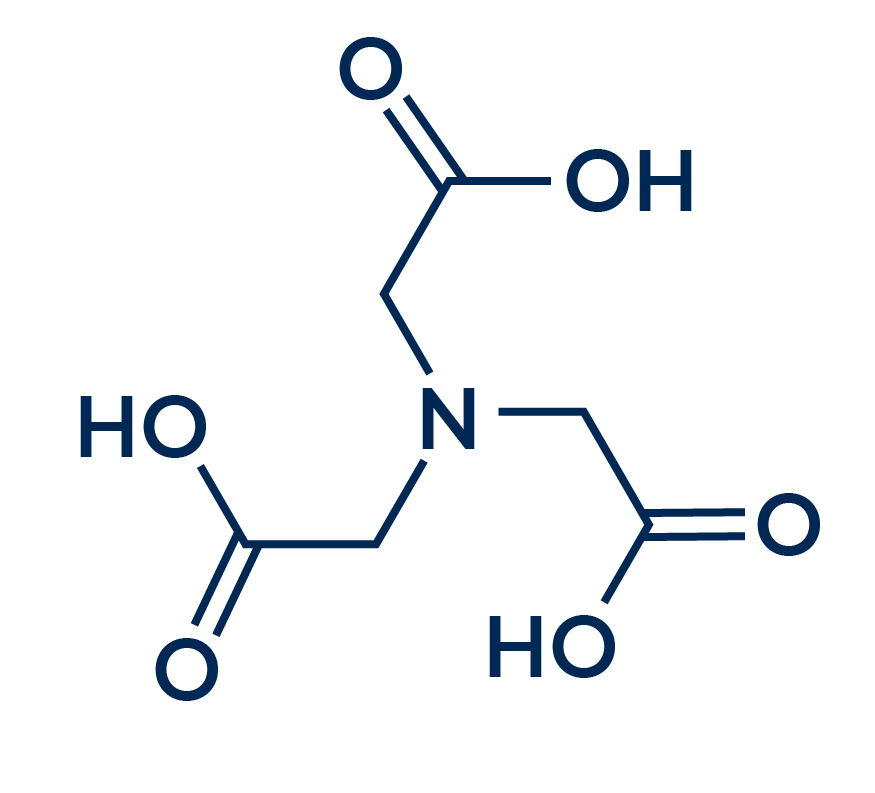
NTA (Ácido Nitrilotriacético)
O ácido nitrilotriacético é uma opção ecologicamente mais viável que o EDTA, sendo esta uma substância biodegradável. Este sequestrante é obtido como um subproduto da síntese do EDTA, mas também pode ser fabricado a partir de síntese química. No entanto, esta síntese não é muito simples, visto que é uma síntese que necessita de reagentes extremamente tóxicos, como formaldeído, cianeto de sódio e cianeto de hidrogênio.
Além da toxicidade presente na síntese deste produto, vale destacar que este sequestrante apresenta uma toxicidade superior à do EDTA, ou seja, mesmo sendo uma alternativa biodegradável de sequestrante, seu uso implica diversos riscos, dentre os quais se destacam a irritabilidade aos olhos, pele e trato respiratório, além de ser classificado como um possível carcinogênico para humanos.
Então, apesar deste sequestrante ser eficaz na complexação de íons metálicos como Cálcio, Magnésio e Ferro, seu uso deve ser muito bem pensado devido aos riscos inerentes da substância.
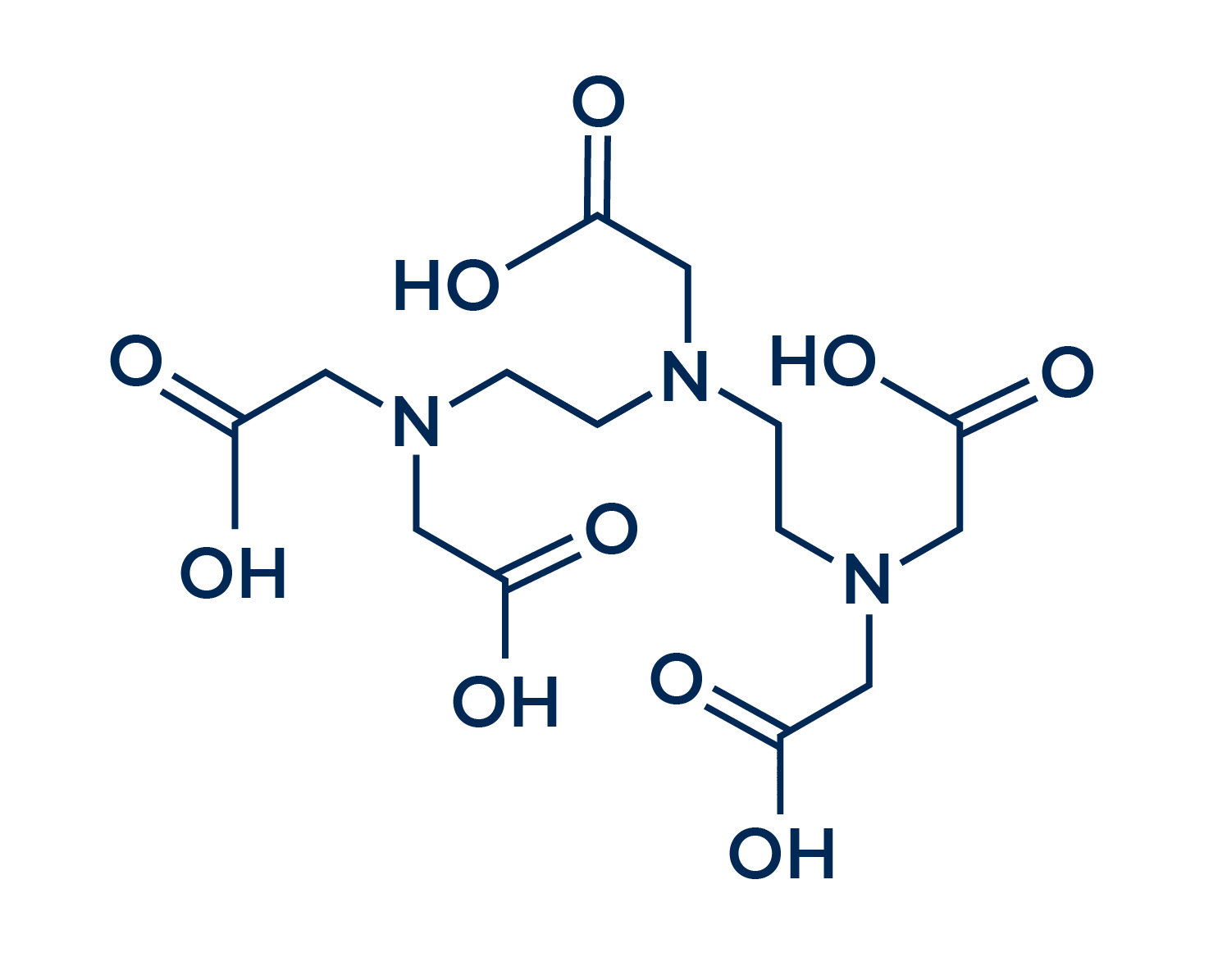
DTPA (Ácido Dietilenotriaminopentacético)
O DTPA é um sequestrante mais seletivo e mais eficaz na complexação de alguns íons metálicos do que o EDTA. No entanto, destaca-se que este sequestrante apresenta uma baixíssima solubilidade em água, diferente do concorrente EDTA.
O DTPA é um ligante octadentado, o que garante a esta substância uma excepcional capacidade quelante. Com esta característica, este sequestrante é capaz de formar complexos inclusive com elementos radioativos, como o tório, urânio e plutônio. Estes complexos facilitam a excreção destas substâncias de forma mais segura pela urina, o que torna o potencial medicinal deste sequestrante interessante. Além do uso em tratamento de radiação, o DTPA também pode ser empregado como contraste para exames de ressonância magnética.
Dito isso, tem-se que o DTPA é um sequestrante extremamente potente, mas seus usos no campo farmacêutico e medicinal tornam seu custo normalmente inviável para a maioria dos empregos da indústria química. Além disso, ser uma substância de baixa solubilidade faz com que sua aplicação seja ainda mais complexa.
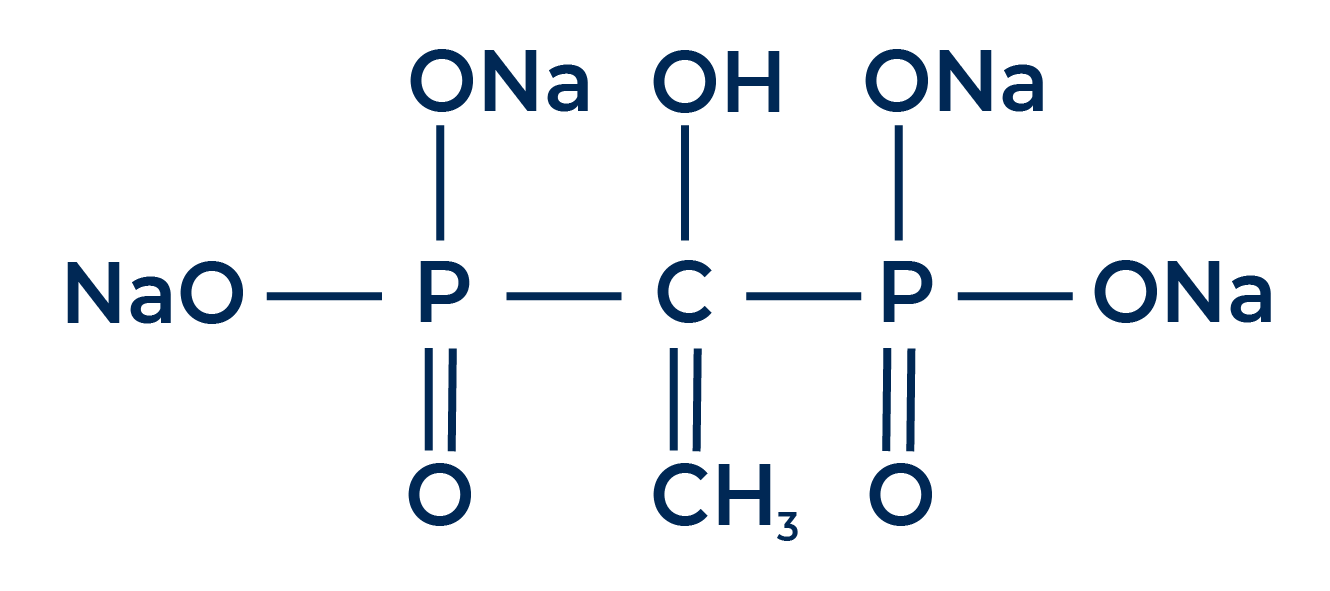
HEDP (Ácido 1-Hidroxi-Etilideno-1,1-Difosfônico)
O ácido 1-hidroxietileno 1,1-difosfônico, ou ácido etidrônico, ou simplesmente HEDP é mais uma alternativa comum de sequestrante disponível no mercado. Uma diferença marcante deste sequestrante em relação aos demais já apresentados aqui é o fato de o HEDP não ser uma molécula nitrogenada, mas sim um bifosfonato.
Com relação aos impactos ambientais, o HEDP apresenta um problema semelhante ao do EDTA: ele também não é uma molécula biodegradável. No entanto, essa falta de biodegradação pode gerar ainda mais impactos no caso do HEDP, pois esta molécula é fortemente adsorvida pelo solo, o que aumenta consideravelmente os níveis de fósforo no solo.
O fósforo é um elemento que causa uma considerável preocupação, visto que seu acúmulo no meio ambiente gera danos consideráveis. A presença de tal elemento, inclusive, pode ser proibitiva em inúmeros produtos, visto que a comercialização de produtos contendo fósforo são bem restritas em diversos países.
Este sequestrante apresenta uma melhor afinidade com o ânion Fe³, mas, de forma geral, seu desempenho é semelhante ao do EDTA. Deve-se destacar também que o HEDP é menos estável em meios contendo cloro do que o EDTA, o que pode vir a ser um problema na aplicação em produtos que contenham cloreto de sódio.
GLDA (Sal Tetrassódico do Ácido Glutâmico Diacetato)
O GLDA é um sequestrante verde poderoso e prontamente biodegradável, que é produzido a partir de um aminoácido natural. Além deste forte apelo de baixo impacto ambiental, o GLDA também se destaca como um sequestrante de toxicidade muito baixa: se comparado com o EDTA, que apresenta riscos por ingestão, pode provocar lesões oculares graves e ainda é um forte irritante respiratório, o GLDA não apresenta toxicidade aguda de nenhum tipo e nem é considerado um irritante, o que aprimora o leque de aplicações desta substância.
Agora, vejamos quais benefícios o GLDA ainda apresenta em relação a outros sequestrantes, além do fator da biodegradabilidade. Uma propriedade de destaque imediatamente muito interessante do GLDA é que ele é uma substância que apresenta efetividade no combate a bolores e bactérias, tanto Gram negativas quanto Gram positivas, pois é capaz de privar as paredes celulares de cátions, enfraquecendo-as e potencializando a ação de outras substâncias biocidas. Existem diversos testes que indicaram que a adição do GLDA às formulações biocidas reduzem ao redor de 30% do custo da formulação, sem afetar o desempenho.
Por fim, podemos avaliar e comparar o equivalente de quelação do GLDA e do EDTA. O equivalente de quelação é a quantidade de substância pura, ou seja, com 100% de ativo, que é necessária para remover 1 g de algum tipo de metal da solução. Os dados a seguir valem para um intervalo de pH de 7 a 10.
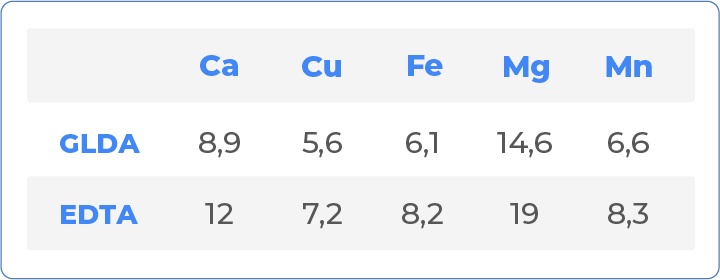
Observe que os equivalentes de quelação dos dois produtos são muito parecidos, apesar de uma ligeira vantagem do GLDA. Ou seja, conforme indicam os dados desta tabela, é possível realizar uma substituição de EDTA por GLDA numa razão de 1:1.
Em resumo, podemos ver que o GLDA se mostra como um excelente substituto para o EDTA, oferecendo uma alternativa de baixa agressão ao meio ambiente, com menor toxicidade e com um desempenho equivalente.
Como escolher o sequestrante ideal?
A escolha do sequestrante ideal para uma formulação é uma decisão estratégica que deve levar em consideração diversos fatores.
Entre os mais importantes estão:
- Os íons metálicos presentes: É fundamental identificar quais íons metálicos estão presentes na água ou em outros ingredientes da formulação, pois cada sequestrante tem afinidade com determinados tipos de íons.
- As propriedades desejadas do produto: O sequestrante deve ser compatível com as propriedades desejadas do produto final, como viscosidade, textura, cor, perfume e estabilidade.
- A relação custo-benefício: O custo do sequestrante deve ser considerado em conjunto com seus benefícios para o produto final.
A escolha correta do sequestrante garante a qualidade e a segurança do produto final, além de contribuir para a otimização de seus custos e da sua performance.
Para obter orientação na escolha do sequestrante ideal para cada aplicação, entre em contato com o nosso SmartLab.

Leia também
Existem casos em que a espuma é indesejada, passando a ser prejudicial para o processo de limpeza. O objetivo deste artigo é elucidar os caminhos possíveis e viáveis, agilizando o processo de desenvolvimento de um produto com essa característica
Talvez um dos produtos químicos mais conhecidos e utilizados pelo consumidor brasileiro e que influencia drasticamente na cultura e comportamento no que diz respeito à limpeza é o Hipoclorito de Sódio, o famoso “cloro”.
Quando a temperatura muda, podem surgir turbidez, separação de fases, formação de cristais ou alterações na viscosidade. Dois parâmetros são especialmente importantes nessa análise: o ponto de névoa e o ponto de turvação.
Nossa química
Usamos nosso laboratório para criar soluções
químicas inteligentes em equilíbrio com a sua realidade.
Produtos
Usamos nosso centro de P&D, um laboratório próprio com profissionais experientes, para entregar soluções químicas inteligentes em equilíbrio com a sua realidade.