
Uma visão geral sobre tensão superficial e tensoativos
Em uma manhã fresca de outono, ao olhar para um jardim, você nota que as folhas das plantas apresentam inúmeras gotículas em sua superfície. Antes de sair de casa, após lavar o seu rosto, você nota que, enquanto desliga a torneira, o filete de água vai diminuindo e, aos poucos, a água começa a gotejar. Em dias de verão, na superfície de um lago calmo, é comum ver mosquitos andando sobre a água, sem afundar.
.jpg)
Certamente você já se deparou com algum dos fenômenos citados acima. E o que esses fenômenos têm em comum? A resposta é relativamente simples: todos eles apresentam explicações centradas em um conceito chamado de tensão superficial.
Mas o que é esta tal tensão superficial?
Será que podemos aplicar este conceito de tensão superficial de forma prática no desenvolvimento de produtos para o nosso dia a dia? Vamos tentar elaborar essa sequência de pensamentos, para construir um dos conceitos mais empregados industrialmente, o de tensoativos.
Para isso, manteremos um elemento em comum citado em todos os exemplos acima: o da água. Convém que analisemos esta substância em um nível menor do que o microscópico, vejamos como é a sua molécula:
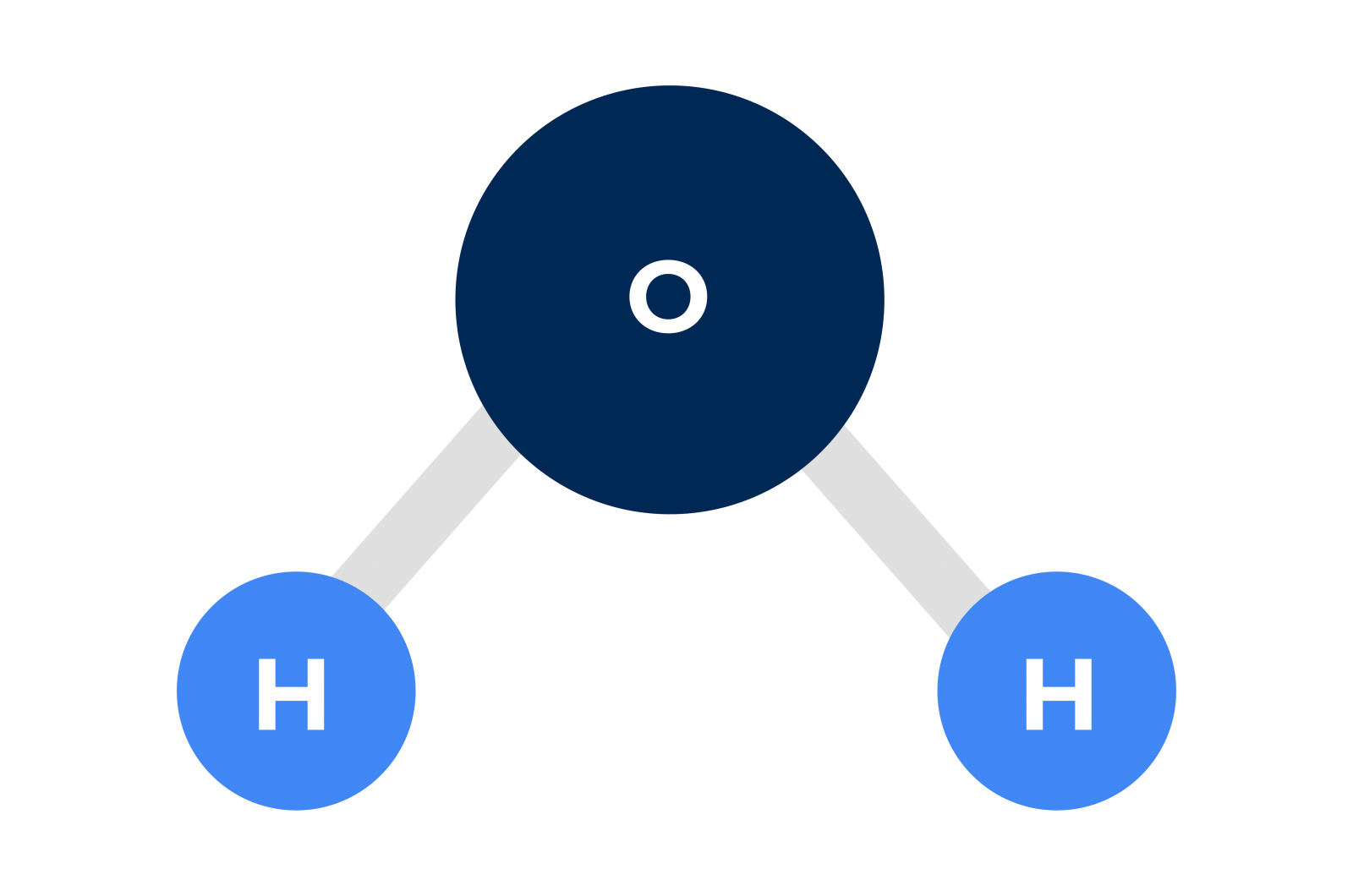
Esta molécula é composta por dois átomos de hidrogênio e um átomo de oxigênio em uma posição angular muito específica. Acontece que o oxigênio é um átomo que apresenta uma elevada eletronegatividade, ou seja, quando se encontra ligado quimicamente, apresenta uma tendência a atrair os elétrons de outros átomos para próximo de si, tornando seus arredores uma região de alta probabilidade de se encontrar elétrons. Essa atração sobre os elétrons dos átomos de hidrogênio ligados a ele faz com que a região dos dois átomos de hidrogênio apresente baixa probabilidade de encontrar elétrons.
Então, como os elétrons apresentam uma carga elétrica negativa, a região ao redor do átomo de oxigênio na água apresentará uma carga elétrica global negativa, enquanto a região nos arredores dos átomos de hidrogênio, onde se tem baixa probabilidade de se encontrar elétrons, apresentará uma carga elétrica global positiva.
Ou seja, a molécula da água apresentará duas regiões com concentrações de cargas elétricas bem distintas, sendo uma região com carga negativa e uma região com carga positiva, como mostrado na figura a seguir.
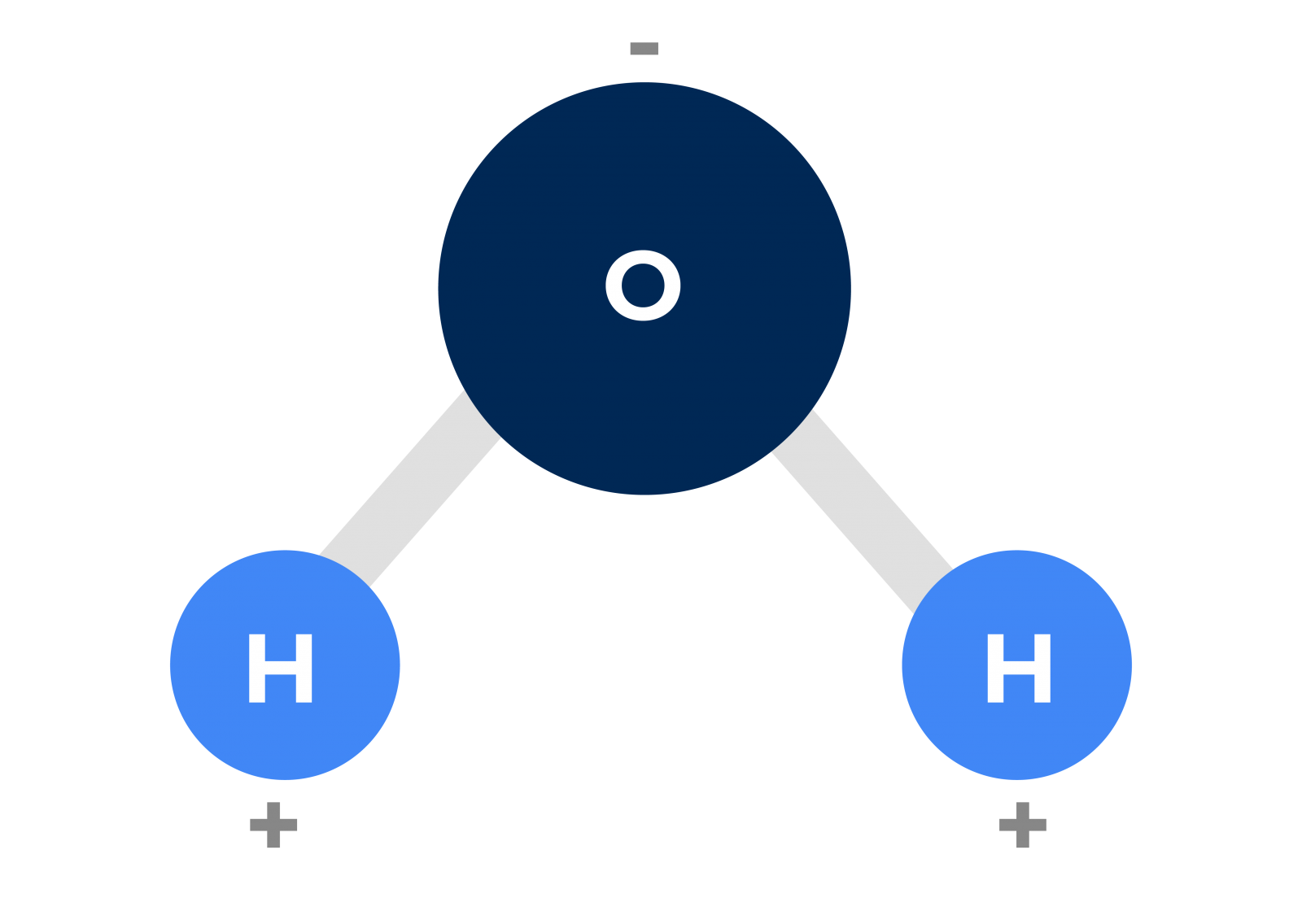
Dessa forma, podemos pensar que cada molécula de água se comporta de forma semelhante a um minúsculo ímã, onde há um polo positivo e um polo negativo. Moléculas que apresentam essa característica são chamadas de moléculas polares.
O que isso tem a ver com a tensão superficial?
Vamos pensar um pouco: considere um copo de água. Se você analisar as moléculas de água contidas no copo, tal qual acontece com ímãs, o polo positivo de uma molécula irá atrair o polo negativo de outras. Como em uma pequena amostra de água existe um número gigantesco de moléculas de água, esse sistema de atração acaba gerando uma gigantesca rede de interações entre as diferentes moléculas de água:
.png)
No entanto, perceba que nem todas as moléculas de água estarão sujeitas à mesma força atrativa: as moléculas de água mais internas, acabam sofrendo a maior força, com atrações de todos os lados, pois estão rodeadas de outras moléculas de água. Essa força de atração entre moléculas iguais é o que chamamos de força coesiva.
Já as moléculas de água mais periféricas, ou seja, as que se encontram na superfície líquida sofrerão atrações de forma desigual. Como o ar é uma mistura de substância apolares, ou seja, não exerce força atrativa sobre as moléculas de água, elas sofrerão atração significativa apenas das moléculas de água abaixo delas. Essa desigualdade de forças atuando nas moléculas superficiais faz com que elas sejam “puxadas” de volta para dentro do líquido, ficando mais próximas umas das outras. Estas moléculas superficiais se encontram sob efeito do que chamamos de forças adesivas.
E como estes dois tipos de força atuando no sistema irão interferir na estabilidade da água dentro do copo? A princípio, a resposta pode não parecer tão simples: haverá uma tendência de redução do número de moléculas na interface entre a água e o ar, pois uma menor quantidade de moléculas nessa região acarreta na minimização das forças superficiais, tornando o sistema mais estável.
Para tentar visualizar melhor esta resposta, pense em um show de um rock star famoso acontecendo em uma casa lotada, onde a única saída é em uma sacada. Sendo o músico famoso, é de se esperar que na aglomeração de fãs (e aqui, cada fã deve ser tratado como uma molécula) apresente-se uma grande quantidade de pessoas que gostam da “muvuca”, se sentindo bem em ficar no meio da plateia, sendo empurradas e esbarrando em todas as pessoas ao redor.
No entanto, nem todos os fãs presentes no show gostam desse empurra-empurra: alguns deles se sentem mais confortáveis apenas em apreciar a música, mesmo que a distância - e esses fãs que gostam menos do contato acabam se posicionando mais na periferia da casa de show, ou seja, alguns poucos ouvintes tenderão a ficar na região da saída (a interface entre a substância fãs e o ar livre). Ou seja, todos os presentes querem acompanhar o show, mas a forma do local faz com que os fãs se posicionem da forma mais confortável para que todos consigam assistir.
E aqui vai uma curiosidade: essa tendência natural de minimizar o número de moléculas em uma superfície que acabamos de mostrar explica também o porquê de as gotas de substâncias polares, como a água, tenderem a ser na forma esférica. Sabendo que na interface ar e água deve haver a minimização das moléculas e que as forças coesivas puxam todas as moléculas para um ponto central, é natural que as gotas apresentem formas próximas da esférica, pois a esfera é a forma geométrica que apresenta a menor razão entre a área superficial e o volume.
Apesar desta afirmação não ser difícil de se demonstrar matematicamente, podemos tentar mostrar isso de outra forma: imagine que um grupo de crianças está em um pátio aberto em um dia frio e, para não se perderem, estas crianças devem ficar de mãos dadas. Como o dia está frio, as crianças tendem a se aproximar para se aquecerem, e, com essa aproximação, logo se organizarão em um grupo circular, ou uma “bolinha de crianças”, tentando manter-se o mais próximas possível para que todas sintam menos frio.
É basicamente isso que acontecerá com as moléculas de água: todas as moléculas irão se atrair mutuamente, assim como as crianças deixadas no pátio aberto citado acima.
Ou seja, com estas explicações dadas aqui, já conseguimos explicar dois dos fenômenos citados no início deste texto.
Finalizando, então, essa força que deve ser superada para que ocorra o aumento da superfície líquida é o que chamamos de tensão superficial. Dito isso, já se percebe que, quanto maior for a polaridade das moléculas, maior será a força atuando para puxar as moléculas da superfície para dentro do líquido.
O que são tensoativos?
Um conceito prático muito útil derivado da definição de tensão superficial é o dos tensoativos.
Os tensoativos são moléculas muito maiores e mais complexas do que aquelas que citamos até o momento: são conhecidas como anfipáticas ou anfifílicas, pois apresentam regiões polares e apolares (também conhecidas como cabeça polar e apolar) o que faz com que uma molécula de tensoativo tenha regiões solúveis em água e regiões solúveis em hidrocarbonetos, óleos e gorduras.
Essas moléculas de tensoativos geralmente aparecem representadas da seguinte forma:

Tipos de tensoativos
A cauda apolar de um tensoativo tende a ser uma cadeia carbônica, ou seja, uma região constituída majoritariamente de átomos de carbono e hidrogênio.
Já a cabeça polar, responsável por sua solubilidade em água, será formada por átomos distintos e o comportamento desta região quando solubilizada ajuda a classificar o tipo de tensoativo.
.png)
Tensoativos aniônicos
Quando um tensoativo solubilizado sofre dissociação e apresenta uma carga global negativa em sua cabeça polar, este tensoativo será classificado como aniônico. Este tipo de polaridade é útil para interagir uma grande variedade de sujeiras, especialmente as sujeiras particuladas, o que faz com que estes tensoativos sejam muito úteis para a composição de detergentes e sabonetes.
De forma geral, os tensoativos aniônicos também apresentam elevada solubilidade em água, mas as baixas temperaturas tendem a reduzir esta solubilidade, o que pode exigir atenção na hora de propor formulações. Outra característica comum dos tensoativos aniônicos é a sua alta espumação, desejada por consumidores em vários tipos de produtos. Apesar destas vantagens, este tipo de tensoativo tende a apresentar uma certa dificuldade para emulsionar óleos e gorduras, se comparado aos outros tipos de tensoativos.
Os tensoativos aniônicos estão entre os mais comuns no mercado, existindo uma grande quantidade de exemplos, como, o Lauril Sulfato de Sódio, o Lauril Éter Sulfato de Sódio, as Alfa Olefinas Sulfonadas e o Ácido Sulfônico.
Tensoativos catiônicos
Quando um tensoativo solubilizado se dissocia e apresenta uma carga global positiva em sua cabeça polar, o tensoativo será classificado como catiônico. Tensoativos que apresentam essa cabeça polar com carga positiva tendem a mostrar boa capacidade antiestática e antimicrobiana, o que faz com que sejam muito comuns em aplicações têxteis, na formulação de cosméticos e na de produtos para desinfecção, como condicionadores de cabelo, amaciantes e desinfetantes.
Apesar de não tão comuns no mercado quanto os tensoativos aniônicos, uma boa quantidade de tensoativos catiônicos também se mostra disponível. A grande maioria deles são baseados no nitrogênio, mas também é possível encontrar tensoativos desta classe baseados no fósforo e no enxofre. Como exemplos, temos o Cloreto de Benzalcônio e o Cloreto de Dialquil Dimetil Amônio.
Cabe aqui um parêntese sobre a mistura de tensoativos, antes de continuarmos: como a carga produzida pelos tensoativos aniônicos e catiônicos são opostas, estes dois tipos de tensoativos tendem a ser incompatíveis, de modo que a sua mistura tem elevada chance de formar precipitados nas formulações, afetando drasticamente e de forma negativa as propriedades dos tensoativos.
Tensoativos não iônicos
Há também a possibilidade de um tensoativo solubilizado não apresentar nenhum tipo de carga, ou seja, ele se solubiliza, mas não dissocia. Neste caso, tem-se um tensoativo do tipo não iônico. Este tipo de tensoativo tende a ser muito versátil, apresentando uma grande quantidade de opções com diversas características, oriundos das mais distintas moléculas. Dada esta vasta gama, é comum separá-los em grupos de acordo com sua capacidade de espumação e um valor conhecido como HLB. O HLB é um valor que apresenta o balanço hidrofílico-lipofílico do tensoativo, refletindo de forma direta na solubilidade do tensoativo - a depender do valor do HLB, seu tensoativo não-iônico apresentará uma maior solubilidade em água ou em óleos e gorduras.
Dentre os diversos tipos de tensoativos não iônicos que podemos encontrar no mercado, alguns exemplos são os alquilglucosídeos, os álcoois graxos etoxilados e os infames nonilfenóis.
Tensoativos anfóteros
Finalmente, existe um último tipo de tensoativo: os tensoativos anfóteros. Este tipo de tensoativo pode, ao se solubilizar, se dissociar ou não, o que implica que poderão apresentar um comportamento de tensoativo aniônico, catiônico ou não iônico. O que determina o comportamento de um tensoativo anfótero é o meio no qual ele se encontra, sendo a acidez uma das principais formas de controlá-lo. Suas propriedades dependem muito das características da cauda hidrofóbica e da cabeça hidrofílica, assim como da posição e tipo de cabeça polar que a molécula apresenta.
De maneira geral, os tensoativos anfóteros não são muito úteis quando empregados de forma exclusiva: este tipo de tensoativo brilha quando é combinado com outros tensoativos, podendo gerar os mais diversos tipos de sinergia. Entretanto, dentre os exemplos de propriedades deste tipo de tensoativo, pode-se citar uma elevada solubilidade em água, boa atividade superficial, elevada estabilidade de espuma, baixa toxicidade e uma rápida biodegradabilidade.
Já como exemplos de tensoativos anfóteros, talvez o mais famoso seja a cocoamidopropil betaína.
Formação de micelas
Ainda quando se fala de tensoativos, existe um outro fenômeno interessante relacionado a eles: a formação de micelas. As micelas são estruturas formadas naturalmente por tensoativos solubilizados quando as regiões de polaridade semelhantes deles se unem:
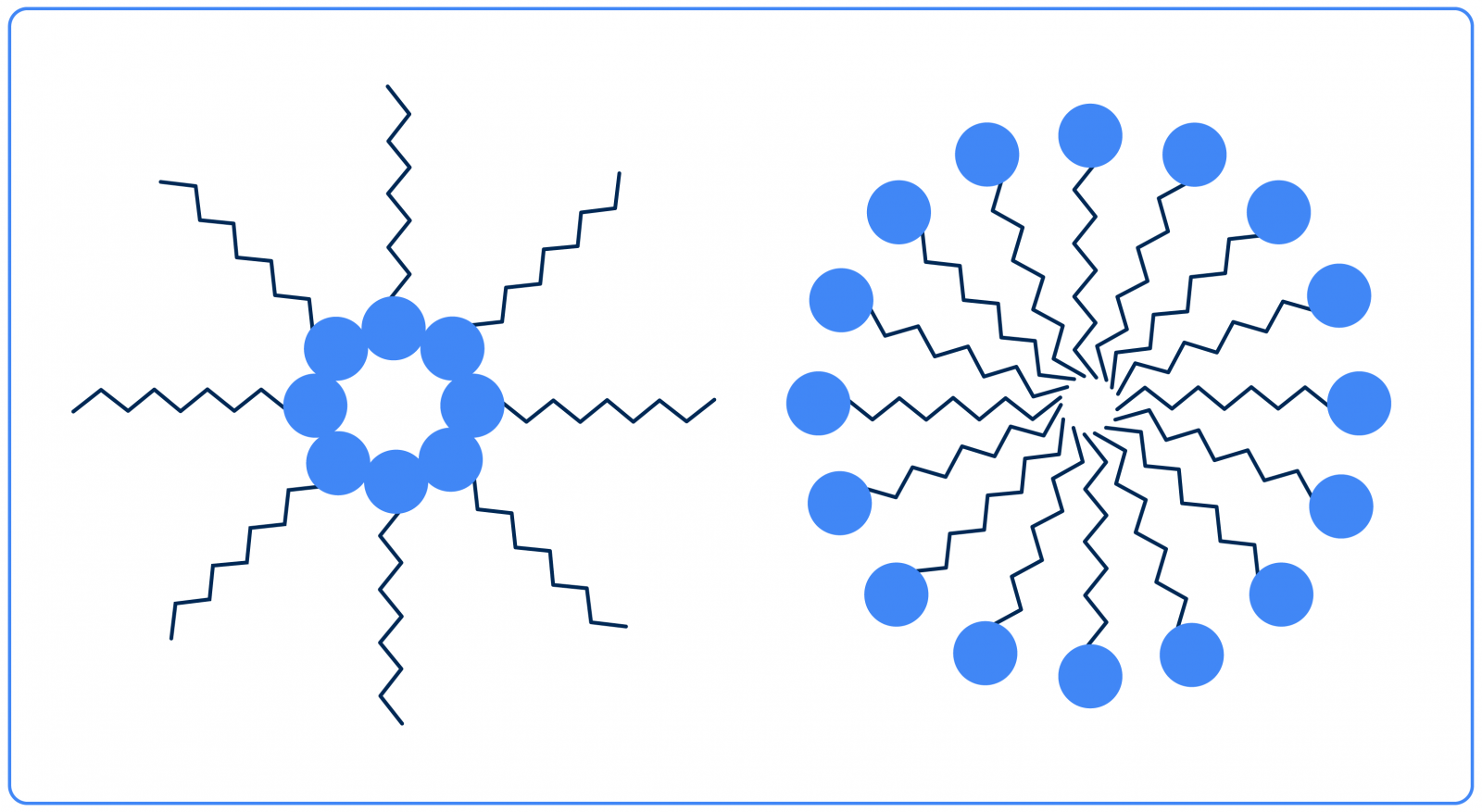
Acima se encontram dois exemplos simples de micelas: a esquerda, uma micela em solução oleosa, pois sua parte apolar está voltada para o exterior, e, a direita, uma micela em solução aquosa, pois as regiões polares se encontram voltadas para o exterior.
Apesar da aparência, não se deve enxergar as micelas como algo estático: elas são altamente dinâmicas e permitem a solubilização de substâncias insolúveis nos líquidos em que os tensoativos se encontram.
Essa característica faz com que possam ser empregadas nas mais diversas finalidades, seja para a limpeza, onde podem solubilizar gorduras em água, por exemplo, até em usos mais complexos, como na dispersão controlada de fármacos.
Vale ressaltar que não é qualquer quantidade de tensoativo disperso em um líquido que será capaz de produzir micelas: existe uma concentração mínima de tensoativos que devem se encontrar em um meio para que este fenômeno tenha início – essa concentração é o que chamamos de concentração micelar crítica, ou CMC.
Para entender melhor essa concentração micelar crítica, é preciso avaliarmos a solubilização de um tensoativo desde o começo. Quando adicionamos uma quantidade ínfima de tensoativo em um pouco de água, essas parcas moléculas de tensoativo irão migrar para a superfície do líquido, na interface entre o líquido e o ar, onde irão sofrer um fenômeno chamado de adsorção.
Se continuarmos adicionando tensoativo lentamente na água, essas novas moléculas continuarão a apresentar esta tendência de movimento de migração para a interface líquido-ar, até que toda esta superfície esteja completamente tomada por moléculas de tensoativos adsorvidas.
Quando a adição de tensoativo for suficiente para que a interface líquido-ar fique saturada, qualquer excedente que for adicionado fará com que a quantidade de moléculas de tensoativos no meio do líquido aumente.
Como os tensoativos são moléculas que apresentam duas regiões bem distintas, a cauda apolar e a cabeça polar, é de se esperar que essas caudas apolares apresentem dificuldade no meio da água, afinal, esta porção das moléculas de tensoativo não é solúvel.
Finalmente, quando a quantidade de moléculas de tensoativos dispersos no líquido, atinge um determinado valor, que é o que chamamos de concentração micelar crítica (CMC), tem-se moléculas de tensoativo suficiente dispersas no líquido para que elas comecem a se encontrar e organizar de forma a proteger suas caudas apolares do contato com a água.
De forma geral, os tensoativos precisam de algo entre 30 e 200 moléculas para que haja a formação de uma micela que proteja de forma eficiente as caudas apolares. Isso pode parecer muito, mas, em termos moleculares, é uma quantidade minúscula. Além disso, para que haja uma chance real de formação destas micelas, não convém pensar em número de moléculas: o correto é pensar em concentração de tensoativo, ou seja, quantas moléculas de tensoativo se tem para a massa líquida.
Sendo assim, apesar de uma micela precisar de algo entre 30 e 200 moléculas de tensoativo para se formar, em termos de concentração, a maioria dos tensoativos precisará estar presente em uma concentração de até 1% para que o fenômeno de formação de micelas tenha início.
Adiante iremos comentar brevemente sobre o comportamento de medidas da tensão superficial em relação à concentração de tensoativos no meio, avaliando brevemente essa concentração micelar crítica por outro ponto de vista.
Mas qual a relação dos tensoativos com a tensão superficial da água?
Como a tensão superficial é diretamente ligada a atração que as moléculas geram entre si, com a inserção de tensoativos, que possuem regiões polares e apolares, a força atrativa entre as moléculas de água irá baixar, pois enfrentarão “intrusos” que diminuem sua força. Assim, quanto mais tensoativo for adicionado em uma solução aquosa, menor será a tensão superficial desta solução.
No entanto, essa diminuição da tensão superficial não é infinita: a mínima tensão superficial de uma solução aquosa será atingida quando a CMC do tensoativo estiver presente no meio. A partir desta concentração, qualquer adição de tensoativo não baixará mais a tensão superficial da solução aquosa.

Quer conhecer mais sobre os tensoativos e suas aplicações? Precisa de auxílio para escolher o tensoativo ideal para cada aplicação? Gostaria de avaliar os efeitos de uma combinação de diferentes tensoativos?
O SmartLab da Macler se encontra de prontidão para auxiliar em todas essas questões. Nossos especialistas alinham conhecimento técnico e resultados práticos, que podem auxiliar a sua empresa em todas as etapas de desenvolvimento do seu produto.
Entre em contato e fale com um especialista.

Leia também
Existem casos em que a espuma é indesejada, passando a ser prejudicial para o processo de limpeza. O objetivo deste artigo é elucidar os caminhos possíveis e viáveis, agilizando o processo de desenvolvimento de um produto com essa característica
Talvez um dos produtos químicos mais conhecidos e utilizados pelo consumidor brasileiro e que influencia drasticamente na cultura e comportamento no que diz respeito à limpeza é o Hipoclorito de Sódio, o famoso “cloro”.
Quando a temperatura muda, podem surgir turbidez, separação de fases, formação de cristais ou alterações na viscosidade. Dois parâmetros são especialmente importantes nessa análise: o ponto de névoa e o ponto de turvação.
Nossa química
Usamos nosso laboratório para criar soluções
químicas inteligentes em equilíbrio com a sua realidade.
Produtos
Usamos nosso centro de P&D, um laboratório próprio com profissionais experientes, para entregar soluções químicas inteligentes em equilíbrio com a sua realidade.