
Secuestrantes: función e importancia en las formulaciones
Cuando hablamos de formulaciones higienizantes, es muy común hablar de los principales ingredientes activos. Sin embargo, además de ellos, algunas materias primas tienen una gran importancia y ejercen una gran influencia en las formulaciones, como los secuestrantes de los que hablaremos en este artículo.
¿Qué son los secuestrantes?
Los secuestrantes, también conocidos como agentes quelantes, son sustancias cuyas moléculas tienen una característica muy distintiva porque su estructura molecular presenta una peculiaridad: tienen una estructura con regiones que suelen parecerse a dientes o garras.
Esta estructura distintiva es incluso la responsable del nombre quelante, que procede de la palabra griega chele, que significa garra.
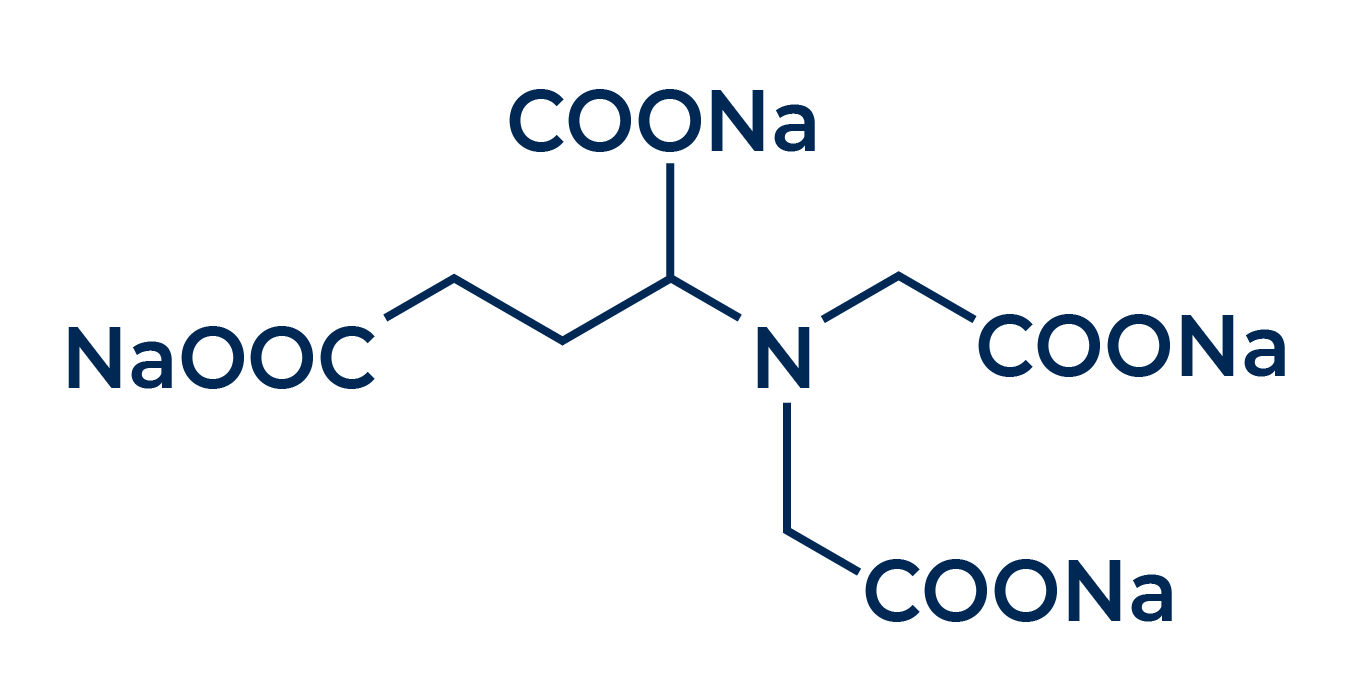
Visualicemos estas garras en la estructura de un famoso secuestrante, el EDTA. A continuación se muestra la estructura de la molécula de este secuestrante, con sus garras destacadas en rojo:
.png)
Estas garras no sólo son visuales, sino que también tienen una habilidad única: pueden “pinzar” o “aprisionar” iones metálicos, retirándolos del medio acuoso mediante un proceso conocido como complejación.
Desde un punto de vista más técnico, los secuestrantes son moléculas responsables de formar un complejo con una estructura en forma de anillo mediante conjugación por enlaces covalentes dativos con iones metálicos, es decir, son moléculas responsables de formar complejos con iones metálicos, secuestrándolos.
Esta capacidad de “aprisionar” los iones metálicos impide que interfieran con otros componentes de la fórmula, asegurando la estabilidad, eficacia y seguridad del producto final.
De este modo, en una formulación desinfectante, los secuestrantes acaban siendo los responsables de proteger el principio activo, ya que el agua potable siempre contendrá una cierta cantidad de iones metálicos disueltos, lo que también se conoce como dureza del agua.
En formulaciones con tensioactivos catiónicos, los secuestrantes protegen el ingrediente activo secuestrando iones de la dureza del agua, aumentando su eficacia para eliminar cationes importantes necesarios para la actividad de membrana de los microorganismos.
En las formulaciones con tensioactivos aniónicos, los secuestrantes aumentan el rendimiento del ingrediente activo y mejoran atributos como la formación de espuma.
¿Cómo protegen los secuestrantes a los principios activos catiónicos?
Los principios activos catiónicos de las formulaciones desinfectantes, por ejemplo, están protegidos por los secuestrantes de diferentes maneras:
- Complejación de iones metálicos: los secuestrantes iónicos se unen a los iones metálicos presentes en el agua, sobre todo al calcio y al magnesio, formando complejos estables. Esto impide que los iones metálicos se unan al ingrediente activo catiónico del desinfectante, reduciendo su eficacia. La reducción de la eficacia se debe a que el ingrediente activo catiónico acaba «confundiendo» los iones de calcio y magnesio con la membrana de los microorganismos y “atacando” a estos iones en lugar de hacer su trabajo de atacar y eliminar al microorganismo.
- Prevención de la precipitación: los iones metálicos pueden reaccionar con el ingrediente activo catiónico del desinfectante y formar precipitados insolubles. Esto puede reducir la concentración del ingrediente activo catiónico en la solución y hacer que el desinfectante sea menos eficaz. Los secuestrantes iónicos se unen a los iones metálicos y los impiden reaccionar con el ingrediente activo catiónico, evitando la formación de precipitados.
- Mejor estabilidad: los secuestrantes iónicos pueden ayudar a proteger el activo catiónico de la degradación por oxidación u otras reacciones químicas. Esto puede mejorar la estabilidad del desinfectante y aumentar su vida útil. Evitan que se produzcan reacciones de oxidación de metales en colorantes y fragancias.
¿Cómo protegen los secuestrantes al principio activo aniónico?
El uso de secuestrantes en regiones donde la dureza del agua es elevada es esencial para asegurar la calidad y estabilidad del producto. El secuestrante impide que los iones de calcio y magnesio reaccionen con los tensioactivos del detergente, protegiéndolos y garantizando la formación de espuma y la estabilidad del producto, ya que el agua dura tiene un impacto directo en la formación de espuma debido a la presencia de iones metálicos.
Estos iones reaccionan con los tensioactivos del detergente, responsables de la formación de espuma, y forman precipitados insolubles. Esto reduce la cantidad de surfactantes disponibles para la formación de espuma, lo que resulta en una espuma menos abundante y más fina.
Aunque la cantidad de espuma no es necesariamente un indicador de la eficacia del detergente, se asocia directamente con una falta de calidad por parte del
consumidor, y si el ingrediente activo es insoluble, no tendrá capacidad de limpieza.
Ejemplos de secuestrantes
Cada secuestrante tiene características y aplicaciones específicas, por lo que es fundamental elegir el más adecuado para cada necesidad.
EDTA (Ácido Etilendiaminotetraacético)
El EDTA es uno de los secuestrantes más utilizados debido a su gran eficacia y versatilidad, ya que puede unirse a una amplia gama de iones metálicos. Sin embargo, también es un secuestrante muy ivo, lo que significa que puede unirse a iones metálicos específicos sin unirse a otros iones presentes en la solución.
Es eficaz en la complejación de una amplia gama de iones metálicos, entre ellos: Calcio, Magnesio, Hierro y Cobre. Es relativamente barato y fácil de usar.

El EDTA secuestra los iones metálicos mediante un proceso conocido como quelación. La molécula de EDTA tiene seis grupos donadores de electrones: cuatro grupos carboxílicos y dos grupos aminos. Estos grupos donadores de electrones se unen a los iones metálicos, formando un complejo estable. La fuerza de la unión entre el EDTA y el ion metálico depende de la carga del ion metálico, del tamaño del ion metálico y de la naturaleza de los grupos donadores de electrones del EDTA.
El EDTA realiza su proceso de quelación, “abrazando” el ion metálico y protegiendo los demás componentes de la formulación.
.png)
A pesar de ser un secuestrante muy utilizado, en la actualidad hay algunos puntos que deben tenerse en cuenta a la hora de optar por el EDTA. En primer lugar, por lo que respecta a las repercusiones medioambientales, el EDTA no es una sustancia biodegradable, hecho que puede causar graves problemas, ya que su presencia en el medio ambiente puede empobrecer el suelo y eliminar sustancias necesarias para la vida tanto en el suelo como en el agua.
Tampoco hay que pasar por alto los riesgos que presenta esta sustancia: en su forma sólida, el EDTA es un polvo que puede causar graves lesiones oculares, además de ser un fuerte irritante de las vías respiratorias y nocivo si se ingiere. Su forma diluida elimina el riesgo de irritación de las vías respiratorias, pero mantiene los demás problemas.
Este conjunto de características ha generado un impulso para el desarrollo y uso de secuestrantes alternativos al EDTA, especialmente con el fin de combatir los daños medioambientales que esta sustancia es capaz de causar.
NTA (Ácido Nitrilotriacético)
El ácido nitrilotriacético es una opción ecológicamente más viable que el EDTA, que es una sustancia biodegradable. Este secuestrante se obtiene como subproducto de la síntesis del EDTA, pero también puede fabricarse mediante síntesis química. Sin embargo, esta síntesis no es muy sencilla, ya que requiere reactivos extremadamente tóxicos como formaldehído, cianuro de sodio y cianuro de hidrógeno.
Además de la toxicidad presente en la síntesis de este producto, cabe destacar que este secuestrante tiene una toxicidad superior a la del EDTA, es decir, aunque se trate de un secuestrante alternativo biodegradable, su uso conlleva diversos riesgos, entre ellos irritabilidad para los ojos, la piel y las vías respiratorias, además de estar clasificado como posible carcinógeno para los seres humanos.
Por lo tanto, aunque este secuestrante es eficaz en la complejación de iones metálicos como el Calcio, el Magnesio y el Hierro, su uso debe considerarse cuidadosamente debido a los riesgos inherentes de la sustancia.
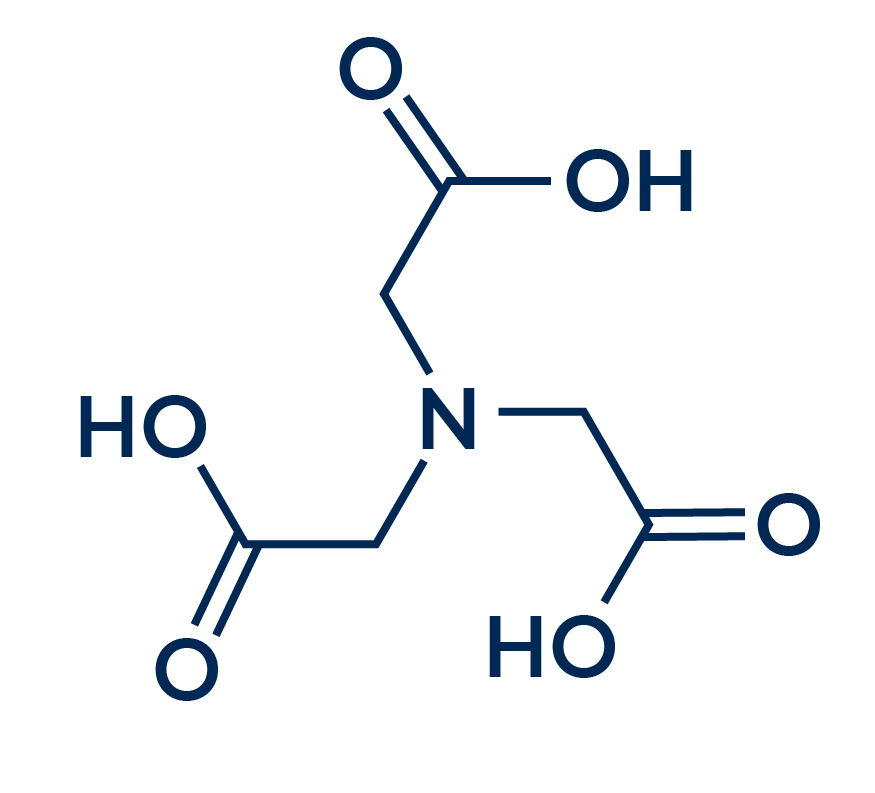
DTPA (Ácido Dietilentriaminopentaacético)
El DTPA es un secuestrante más ivo y más eficaz que el EDTA para formar complejos con algunos iones metálicos. Sin embargo, este secuestrante tiene una solubilidad muy baja en agua, a diferencia de su competidor el EDTA.
El DTPA es un aglutinante octadentado, lo que confiere a esta sustancia una capacidad quelante excepcional. Con esta característica, este secuestrante es capaz de formar complejos incluso con elementos radiactivos como el torio, el uranio y el plutonio. Estos complejos facilitan la excreción más segura de estas sustancias a través de la orina, lo que hace interesante el potencial medicinal de este secuestrante. Además de su uso en radioterapia, el DTPA también puede emplearse como agente de contraste en resonancias magnéticas.
Dicho esto, el DTPA es un secuestrante extremadamente potente, pero sus usos en el campo farmacéutico y medicinal hacen que su coste sea inviable para la mayoría de los trabajos de la industria química. Además, al tratarse de una sustancia de baja solubilidad, su aplicación resulta aún más compleja.
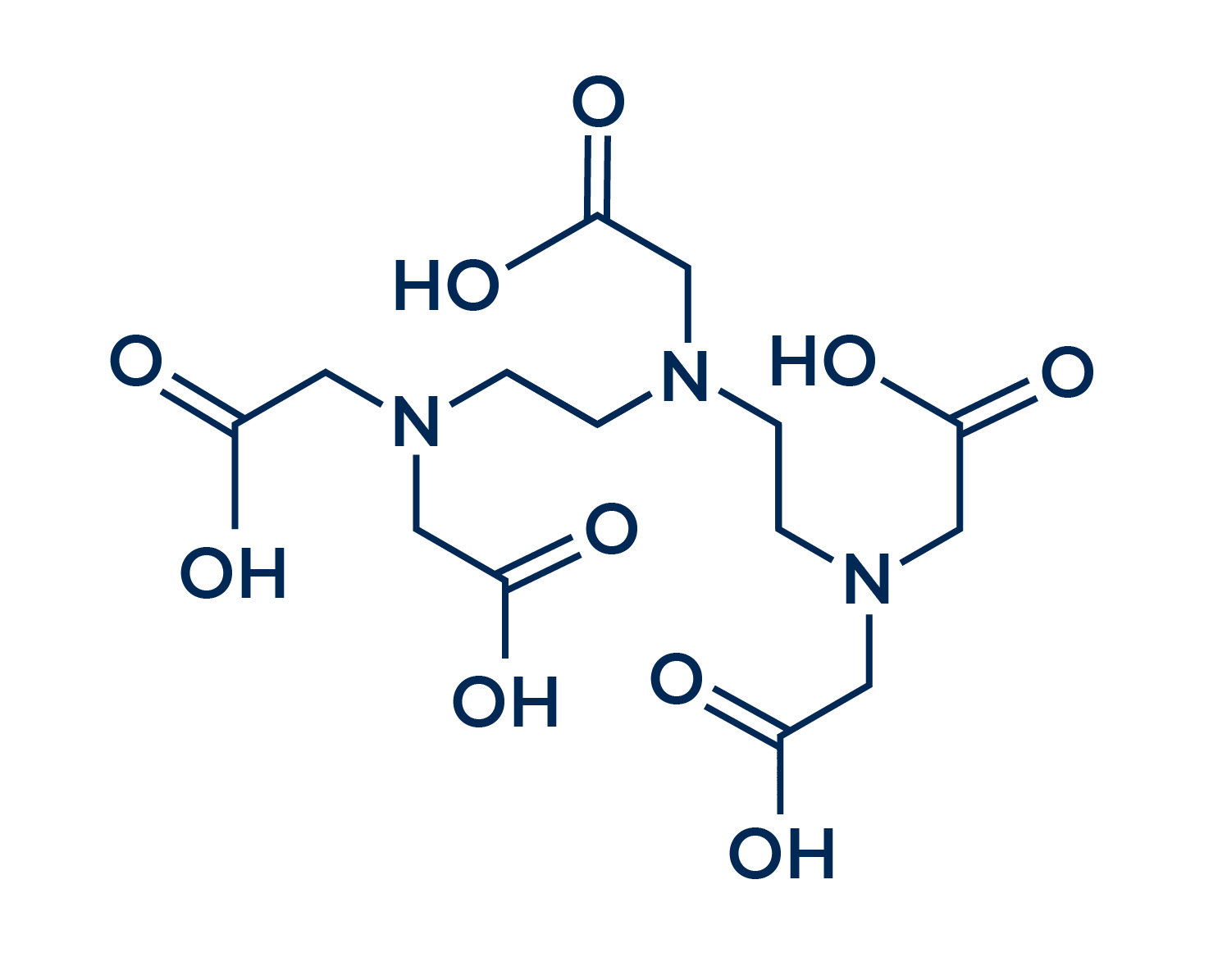
HEDP (Ácido 1- Hidroxietileno-1,1-Difosfónico)
El ácido 1-hidroxietileno-1,1-difosfónico, o ácido etidrónico, o simplemente HEDP, es otra alternativa común de secuestrante disponible en el mercado. Una diferencia notable entre este secuestrante y los demás presentados aquí es que el HEDP no es una molécula de nitrógeno, sino un bifosfonato.
En cuanto a los impactos medioambientales, el HEDP presenta un problema similar al del EDTA: tampoco es una molécula biodegradable. Sin embargo, esta falta de biodegradación puede generar aún más impactos en el caso del HEDP, ya que esta molécula es fuertemente absorbida por el suelo, lo que aumenta considerablemente los niveles de fósforo en el mismo.
El fósforo es un elemento que causa gran preocupación, ya que su acumulación en el medio ambiente genera daños considerables. La presencia de este elemento puede ser incluso prohibitiva en muchos productos, ya que la comercialización de productos que contienen fósforo está muy restringida en varios países.
Este secuestrante tiene mayor afinidad con el anión Fe³, pero en general su rendimiento es similar al del EDTA. También hay que señalar que el HEDP es menos estable en medios que contienen cloro que el EDTA, lo que podría ser un problema cuando se aplica a productos que contienen cloruro sódico.
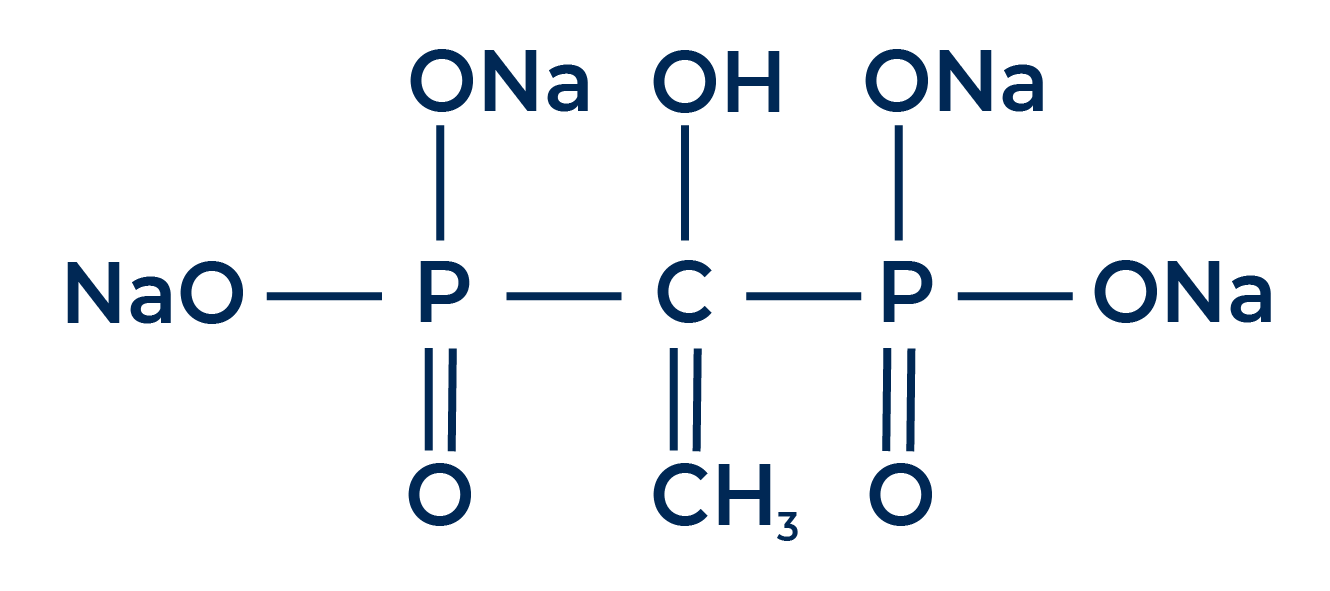
GLDA (Sal Tetrasódica de Ácido Glutámico Diacetato)
GLDA es un potente secuestrante ecológico fácilmente biodegradable que se produce a partir de un aminoácido natural. Además de su gran atractivo por su bajo impacto medioambiental, el GLDA también destaca por ser un secuestrante con una toxicidad muy baja: en comparación con el EDTA, que plantea riesgos por ingestión, puede causar lesiones oculares graves y es también un fuerte irritante respiratorio, el GLDA no tiene ningún tipo de toxicidad aguda y no se considera irritante, lo que mejora la gama de aplicaciones de esta sustancia.
Veamos ahora qué otras ventajas tiene el GLDA sobre otros secuestrantes, aparte del factor de la biodegradabilidad. Una propiedad inmediatamente muy interesante del GLDA es que se trata de una sustancia eficaz para combatir mohos y bacterias, tanto Gram negativas como Gram positivas, porque es capaz de privar de cationes a las paredes celulares, debilitándolas y potenciando la acción de otras sustancias biocidas. Diversas pruebas han demostrado que la adición de GLDA a las formulaciones biocidas reduce el coste de la formulación en torno a un 30%, sin afectar al rendimiento.
Por último, podemos evaluar y comparar el equivalente de quelación de GLDA y EDTA. El equivalente de quelación es la cantidad de sustancia pura, es decir, con un 100% de activo, que se necesita para eliminar 1 g de algún tipo de metal de la solución. Los datos siguientes son válidos para un intervalo de pH de 7 a 10.
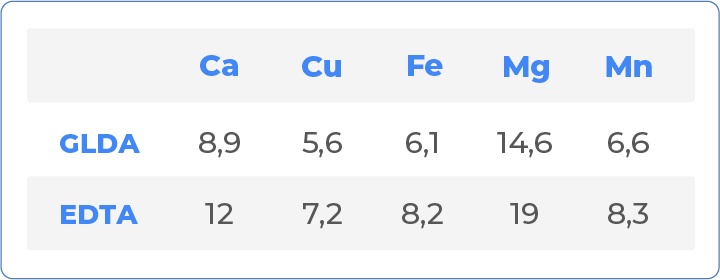
Observe que los equivalentes de quelación de los dos productos son muy similares, a pesar de una ligera ventaja para el GLDA. En otras palabras, como indican los datos de esta tabla, es posible sustituir el EDTA por GLDA en una proporción 1:1.
En resumen, podemos ver que el GLDA parece ser un excelente sustituto del EDTA, ya que ofrece una alternativa favorable al medio ambiente con menor toxicidad y un rendimiento equivalente.
¿Cómo elegir el secuestrante adecuado?
Elegir el secuestrante adecuado para una formulación es una decisión estratégica que debe tener en cuenta varios factores.
Entre los más importantes se encuentran:
- Los iones metálicos presentes: Es esencial identificar qué iones metálicos están presentes en el agua o en otros ingredientes de la formulación, ya que cada secuestrante tiene afinidad por determinados tipos de iones.
- Las propiedades deseadas del producto: El secuestrante debe ser compatible con las propiedades deseadas del producto final, como viscosidad, textura, color, fragancia y estabilidad.
- La relación coste-beneficio: El coste del secuestrante debe considerarse junto con sus beneficios para el producto final.
La elección correcta del secuestrante asegura la calidad y la seguridad del producto final, además de ayudar a optimizar los costes y el rendimiento.
Si desea asesoramiento sobre la elección del secuestrante ideal para cada aplicación, póngase en contacto con nuestro SmartLab.

Lee también
Quizás uno de los productos químicos más conocidos y utilizados por los consumidores brasileños, y que influye drásticamente en la cultura y el comportamiento en lo que respecta a la limpieza, es el hipoclorito de sodio, el famoso "cloro.
Cuando la temperatura cambia, pueden surgir turbidez, separación de fases, formación de cristales o alteraciones en la viscosidad. Dos parámetros son especialmente importantes en este análisis: el punto de niebla y el punto de enturbiamiento.
Nuestra quimica
Usamos nuestro laboratorio para crear soluciones
químicas inteligentes en equilibrio con su realidad.
Productos
Utilizamos nuestro centro de I+D, un laboratorio interno con profesionales experimentados, para ofrecer soluciones químicas inteligentes en equilibrio con su realidad.