
Una visión general sobre la tensión superficial y los tensioactivos
En una fresca mañana de otoño, al mirar un jardín, se observa que las hojas de las plantas presentan numerosas gotitas en su superficie. Antes de salir de casa, después de lavarse la cara, se observa que, al cerrar el grifo, el chorro de agua va disminuyendo y, poco a poco, el agua comienza a gotear. En los días de verano, en la superficie de un lago tranquilo, es habitual ver mosquitos caminando sobre el agua sin hundirse.
.jpg)
Seguramente ya se ha encontrado con alguno de los fenómenos mencionados anteriormente. ¿Y qué tienen en común estos fenómenos? La respuesta es relativamente sencilla: todos ellos tienen explicaciones centradas en un concepto denominado tensión superficial.
Pero, ¿qué es esta tensión superficial?
¿Podemos aplicar este concepto de tensión superficial de forma práctica en el desarrollo de productos para nuestra vida cotidiana? Intentemos desarrollar esta secuencia de pensamientos para construir uno de los conceptos más utilizados industrialmente, el de los tensioactivos.
Para ello, mantendremos un elemento común citado en todos los ejemplos anteriores: el agua. Conviene analizar esta sustancia a un nivel inferior al microscópico, veamos cómo es su molécula:
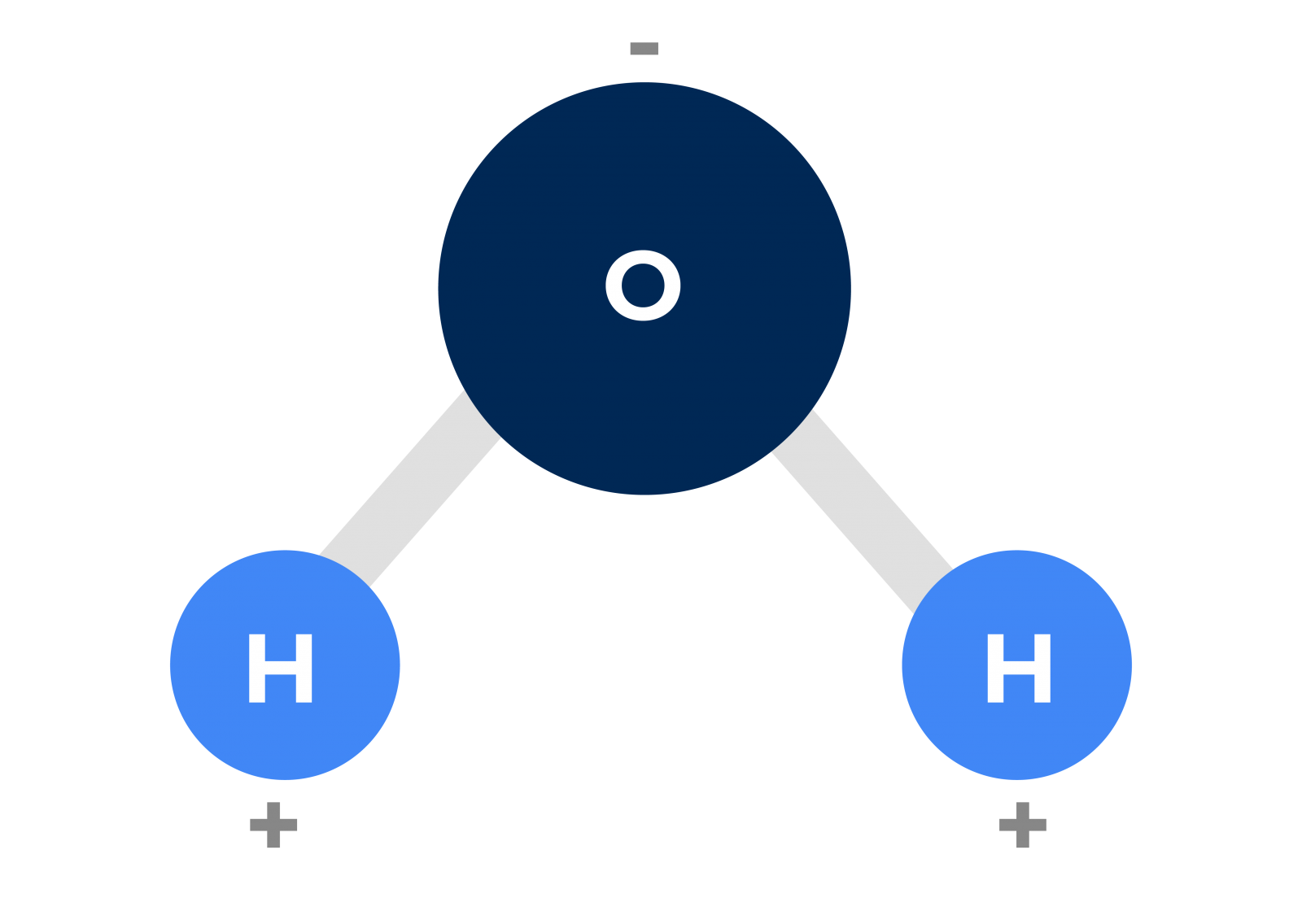
Esta molécula está compuesta por dos átomos de hidrógeno y un átomo de oxígeno en una posición angular muy específica. Resulta que el oxígeno es un átomo que presenta una elevada electronegatividad, es decir, cuando se encuentra químicamente unido, tiende a atraer los electrones de otros átomos hacia sí, lo que convierte su entorno en una zona con alta probabilidad de encontrar electrones. Esta atracción sobre los electrones de los átomos de hidrógeno unidos a él hace que la región de los dos átomos de hidrógeno presente una baja probabilidad de encontrar electrones.
Entonces, como los electrones tienen carga eléctrica negativa, la región alrededor del átomo de oxígeno en el agua tendrá una carga eléctrica global negativa, mientras que la región alrededor de los átomos de hidrógeno, donde hay poca probabilidad de encontrar electrones, tendrá una carga eléctrica global positiva.
Es decir, la molécula de agua presentará dos regiones con concentraciones de cargas eléctricas muy distintas, siendo una región con carga negativa y otra con carga positiva, como se muestra en la siguiente figura.

De esta forma, podemos pensar que cada molécula de agua se comporta de manera similar a un imán minúsculo, donde hay un polo positivo y un polo negativo. Las moléculas que presentan esta característica se denominan moléculas polares.
¿Qué tiene esto que ver con la tensión superficial?
Pensemos un poco: consideren un vaso de agua. Si analizamos las moléculas de agua contenidas en el vaso, al igual que ocurre con los imanes, el polo positivo de una molécula atraerá al polo negativo de otras. Como en una pequeña muestra de agua hay una cantidad enorme de moléculas de agua, este sistema de atracción acaba generando una gigantesca red de interacciones entre las diferentes moléculas de agua:
.png)
Sin embargo, tenga en cuenta que no todas las moléculas de agua estarán sujetas a la misma fuerza de atracción: las moléculas de agua más internas terminan sufriendo la mayor fuerza, con atracciones por todos lados, ya que están rodeadas de otras moléculas de agua. Esta fuerza de atracción entre moléculas iguales es lo que llamamos fuerza cohesiva.
Las moléculas de agua más periféricas, es decir, las que se encuentran en la superficie líquida, sufrirán atracciones desiguales. Como el aire es una mezcla de sustancias apolares, es decir, no ejerce fuerza atractiva sobre las moléculas de agua, estas solo sufrirán una atracción significativa de las moléculas de agua que se encuentran debajo de ellas. Esta desigualdad de fuerzas que actúan sobre las moléculas superficiales hace que sean “atraídas” de nuevo hacia el interior del líquido, quedando más próximas unas de otras. Estas moléculas superficiales se encuentran bajo el efecto de lo que llamamos fuerzas adhesivas.
¿Y cómo estos dos tipos de fuerzas que actúan en el sistema interferirán en la estabilidad del agua dentro del vaso? A primera vista, la respuesta puede no parecer tan sencilla: habrá una tendencia a la reducción del número de moléculas en la interfaz entre el agua y el aire, ya que una menor cantidad de moléculas en esta región conlleva la minimización de las fuerzas superficiales, haciendo que el sistema sea más estable.
Para intentar visualizar mejor esta respuesta, piensen en un concierto de un famoso rock star en un local abarrotado, donde la única salida es por un balcón. Siendo el músico famoso, es de esperar que entre la multitud de fans (y aquí, cada fan debe ser tratado como una molécula) haya una gran cantidad de personas a las que les gusta el “bullicio”, que se sienten bien estando en medio del público, siendo empujados y chocando con todas las personas que les rodean.
Sin embargo, no todos los fans presentes en el concierto disfrutan de este empujón: algunos se sienten más cómodos simplemente disfrutando de la música, aunque sea a distancia, y estos fans que no les gusta tanto el contacto físico acaban situándose más en los alrededores de la sala de conciertos, es decir, unos pocos espectadores tienden a quedarse en la zona de la salida (la interfaz entre la sustancia fans y el aire libre). Es decir, todos los presentes quieren ver el concierto, pero la forma del recinto hace que los fans se coloquen de la forma más cómoda para que todos puedan verlo.
Y aquí va una curiosidad: esta tendencia natural a minimizar el número de moléculas en una superficie que acabamos de mostrar también explica por qué las gotas de sustancias polares, como el agua, tienden a ser esféricas. Sabiendo que en la interfaz entre el aire y el agua debe haber una minimización de las moléculas y que las fuerzas cohesivas atraen todas las moléculas hacia un punto central, es natural que las gotas presenten formas cercanas a la esférica, ya que la esfera es la forma geométrica que presenta la menor relación entre la superficie y el volumen.
Aunque esta afirmación no es difícil de demostrar matemáticamente, podemos intentar mostrarlo de otra manera: imaginen que un grupo de niños está en un patio abierto en un día frío y, para no perderse, deben darse la mano. Como hace frío, los niños tienden a acercarse para calentarse y, al hacerlo, pronto se organizan en un grupo circular, o una “bolita de niños”, tratando de mantenerse lo más cerca posible para que todos sientan menos frío.
Esto es básicamente lo que sucederá con las moléculas de agua: todas las moléculas se atraerán entre sí, al igual que los niños dejados en el patio abierto mencionado anteriormente.
Es decir, con estas explicaciones, ya hemos podido explicar dos de los fenómenos mencionados al principio de este texto.
En conclusión, esta fuerza que debe superarse para que se produzca el aumento de la superficie líquida es lo que llamamos tensión superficial. Dicho esto, ya se puede ver que cuanto mayor sea la polaridad de las moléculas, mayor será la fuerza que actúa para atraer las moléculas de la superficie hacia el interior del líquido.
¿Qué son los tensioactivos?
Un concepto práctico muy útil derivado de la definición de tensión superficial es el de los tensioactivos.
Los tensioactivos son moléculas mucho más grandes y complejas que las que hemos mencionado hasta ahora: se conocen como anfipáticas o anfifílicas, ya que presentan regiones polares y apolares (también conocidas como cabeza polar y apolar), lo que hace que una molécula de tensioactivo tenga regiones solubles en agua y regiones solubles en hidrocarburos, aceites y grasas.
.png)
Tipos de tensioactivos
La cola apolar de un tensioactivo tiende a ser una cadena de carbono, es decir, una región constituida principalmente por átomos de carbono e hidrógeno.
Por su parte, la cabeza polar, responsable de su solubilidad en agua, estará formada por átomos distintos y el comportamiento de esta región cuando se solubiliza ayuda a clasificar el tipo de tensioactivo.
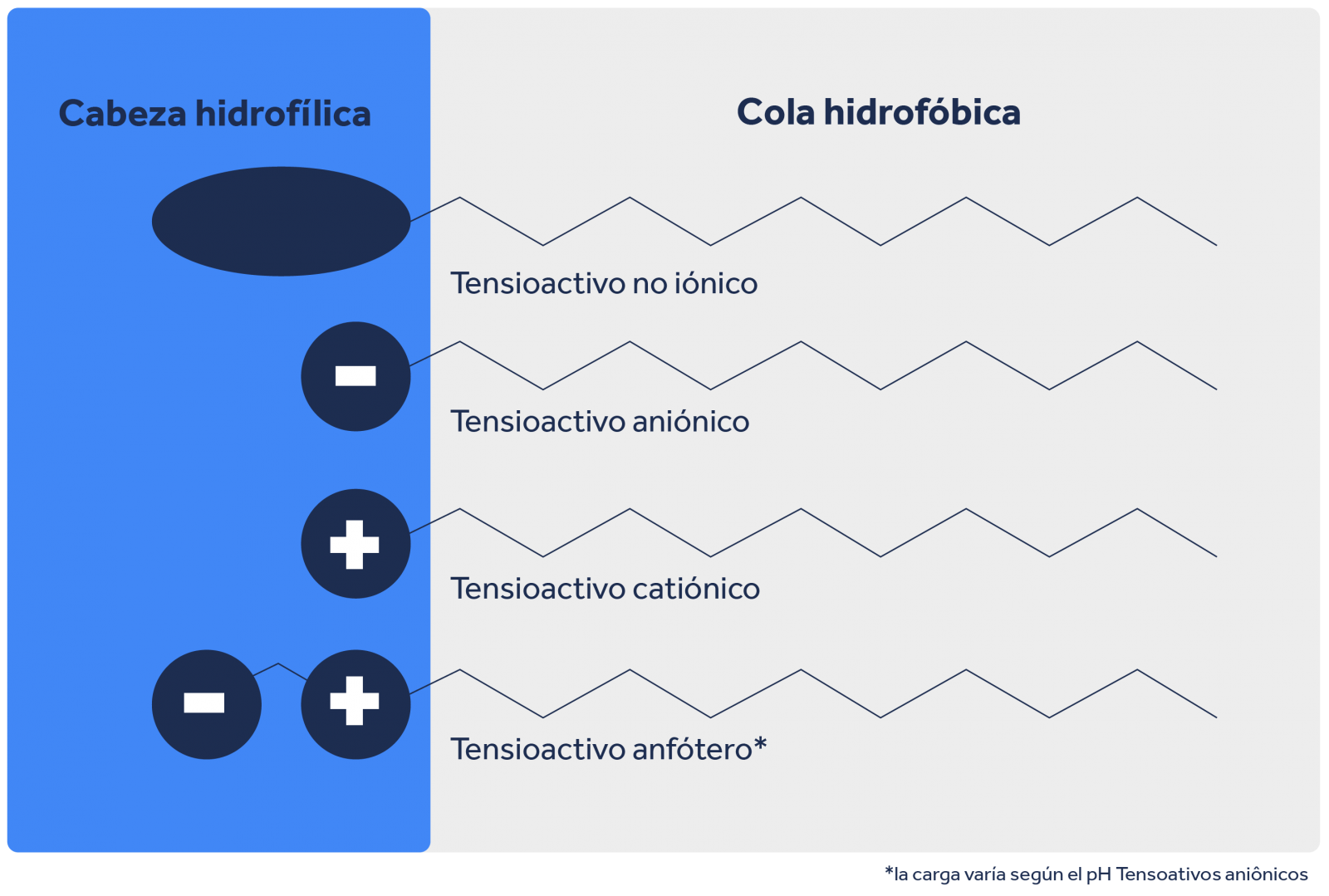
Tensioactivos aniónicos
Cuando un tensioactivo solubilizado sufre disociación y presenta una carga global negativa en su cabeza polar, este tensioactivo se clasificará como aniónico. Este tipo de polaridad es útil para interactuar con una gran variedad de suciedades, especialmente las suciedades particuladas, lo que hace que estos tensioactivos sean muy útiles para la composición de detergentes y jabones.
En general, los tensioactivos aniónicos también presentan una alta solubilidad en agua, pero las bajas temperaturas tienden a reducir esta solubilidad, lo que puede requerir atención a la hora de proponer formulaciones. Otra característica común de los tensioactivos aniónicos es su alta espumación, deseada por los consumidores en varios tipos de productos. A pesar de estas ventajas, este tipo de tensioactivo tiende a presentar cierta dificultad para emulsionar aceites y grasas, en comparación con otros tipos de tensioactivos.
Los tensioactivos aniónicos se encuentran entre los más comunes en el mercado, existiendo una gran cantidad de ejemplos, como el Lauril Sulfato de Sodio, el Lauril Éter Sulfato de Sodio, las Alfa Olefinas Sulfonadas y el Ácido Sulfónico.
Tensioactivos catiónicos
Cuando un tensioactivo solubilizado se disocia y presenta una carga global positiva en su cabeza polar, el tensioactivo se clasificará como catiónico. Los tensioactivos que presentan esta cabeza polar con carga positiva tienden a mostrar una buena capacidad antiestática y antimicrobiana, lo que los hace muy comunes en aplicaciones textiles, en la formulación de cosméticos y en productos para la desinfección, como acondicionadores de cabello, suavizantes y desinfectantes.
Aunque no son tan comunes en el mercado como los tensioactivos aniónicos, también hay una buena cantidad de tensioactivos catiónicos disponibles. La gran mayoría de ellos están basados en nitrógeno, pero también es posible encontrar tensioactivos de esta clase basados en fósforo y azufre. Como ejemplos, tenemos el Cloruro de Benzalconio y el Cloruro de Dialquil Dimetil Amonio.
Antes de continuar, cabe hacer una digresión sobre la mezcla de tensioactivos: dado que la carga producida por los tensioactivos aniónicos y catiónicos es opuesta, estos dos tipos de tensioactivos tienden a ser incompatibles, por lo que su mezcla tiene muchas posibilidades de formar precipitados en las formulaciones, lo que afecta drásticamente y de forma negativa a las propiedades de los tensioactivos.
Tensioactivos no iónicos
También existe la posibilidad de que un tensioactivo solubilizado no presente ningún tipo de carga, es decir, se solubiliza, pero no se disocia. En este caso, se trata de un tensioactivo de tipo no iónico. Este tipo de tensioactivo tiende a ser muy versátil, presentando una gran cantidad de opciones con diversas características, procedentes de las moléculas más distintas. Dada esta amplia gama, es habitual separarlos en grupos según su capacidad de formación de espuma y un valor conocido como HLB. El HLB es un valor que presenta el equilibrio hidrofílico-lipofílico del tensioactivo, reflejándose directamente en la solubilidad del tensioactivo: dependiendo del valor del HLB, su tensioactivo no iónico presentará una mayor solubilidad en agua o en aceites y grasas.
Entre los diversos tipos de tensioactivos no iónicos que podemos encontrar en el mercado, algunos ejemplos son los alquilglucósidos, los alcoholes grasos etoxilados y los infames nonilfenoles.
Tensioactivos anfóteros
Por último, existe un último tipo de tensioactivo: los tensioactivos anfóteros. Este tipo de tensioactivo puede, al solubilizarse, disociarse o no, lo que implica que pueden presentar un comportamiento tensioactivo aniónico, catiónico o no iónico. Lo que determina el comportamiento de un tensioactivo anfótero es el medio en el que se encuentra, siendo la acidez una de las principales formas de controlarlo. Sus propiedades dependen en gran medida de las características de la cola hidrofóbica y de la cabeza hidrofílica, así como de la posición y el tipo de cabeza polar que presenta la molécula.
En general, los tensioactivos anfóteros no son muy útiles cuando se emplean de forma exclusiva: este tipo de tensioactivo brilla cuando se combina con otros tensioactivos, pudiendo generar los más diversos tipos de sinergia. Sin embargo, entre los ejemplos de propiedades de este tipo de tensioactivo, se puede citar una elevada solubilidad en agua, buena actividad superficial, elevada estabilidad de la espuma, baja toxicidad y una rápida biodegradabilidad.
Como ejemplos de tensioactivos anfóteros, quizás el más famoso sea el cocamidopropil betaína.
Formación de micelas
Cuando se habla de tensioactivos, existe otro fenómeno interesante relacionado con ellos: la formación de micelas. Las micelas son estructuras formadas naturalmente por tensioactivos solubilizados cuando se unen regiones de polaridad similar:
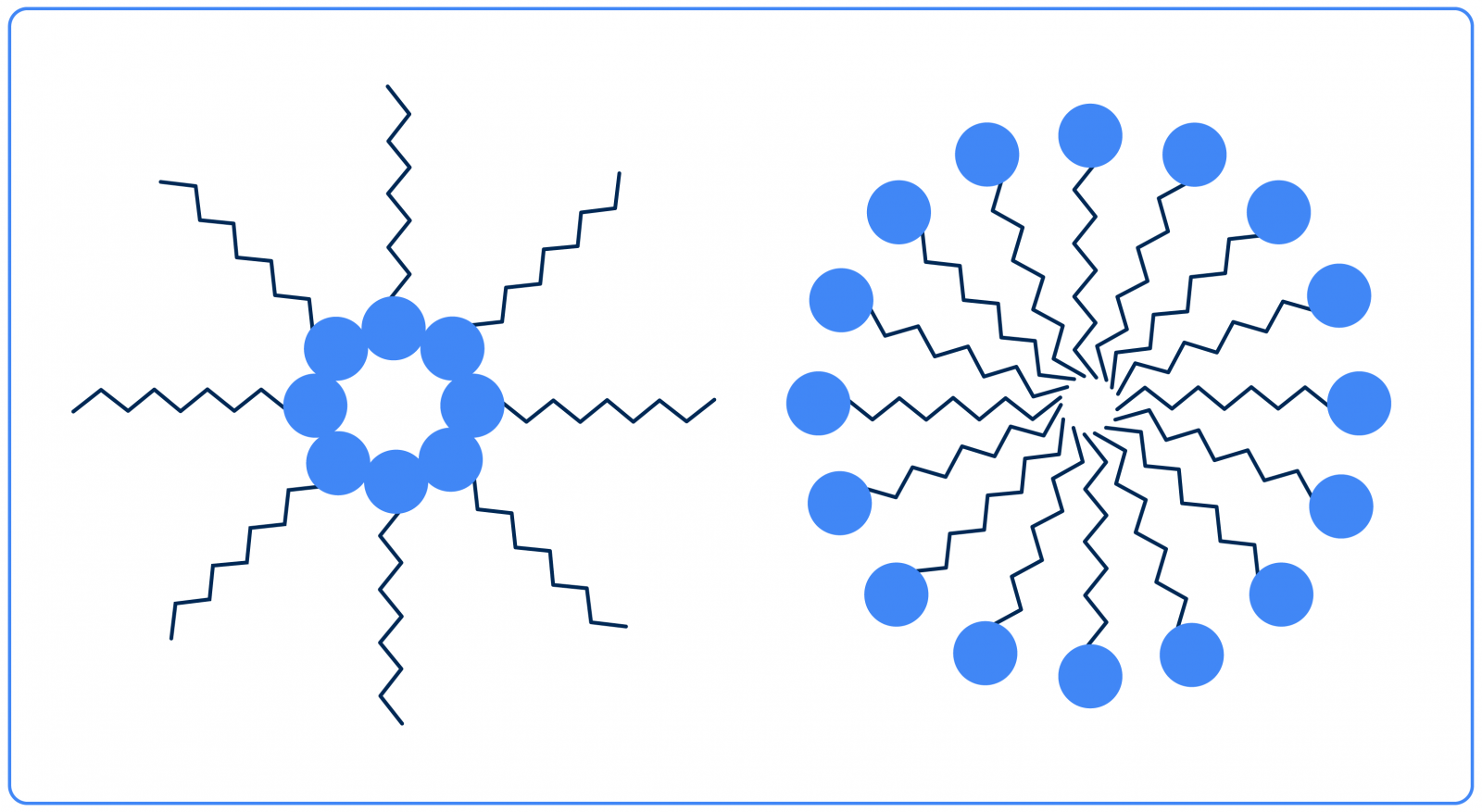
Arriba hay dos ejemplos sencillos de micelas: a la izquierda, una micela en solución oleosa, ya que su parte apolar está orientada hacia el exterior, y a la derecha, una micela en solución acuosa, ya que las regiones polares están orientadas hacia el exterior.
A pesar de su apariencia, las micelas no deben considerarse algo estático: son muy dinámicas y permiten la solubilización de sustancias insolubles en los líquidos en los que se encuentran los tensioactivos.
Esta característica hace que puedan emplearse para los fines más diversos, desde la limpieza, donde pueden solubilizar grasas en agua, por ejemplo, hasta usos más complejos, como la dispersión controlada de fármacos.
Cabe destacar que no cualquier cantidad de tensioactivo disperso en un líquido es capaz de producir micelas: existe una concentración mínima de tensioactivos que debe encontrarse en un medio para que este fenómeno se inicie, concentración que denominamos concentración micelar crítica o CMC.
Para comprender mejor esta concentración micelar crítica, es necesario evaluar la solubilización de un tensioactivo desde el principio. Cuando añadimos una cantidad ínfima de tensioactivo en un poco de agua, estas escasas moléculas de tensioactivo migrarán hacia la superficie del líquido, en la interfaz entre el líquido y el aire, donde sufrirán un fenómeno denominado adsorción.
Si seguimos añadiendo tensioactivo lentamente al agua, estas nuevas moléculas seguirán mostrando esta tendencia de movimiento de migración hacia la interfaz líquido-aire, hasta que toda esta superficie quede completamente cubierta por moléculas de tensioactivos adsorbidos.
Cuando la adición de tensioactivo sea suficiente para que la interfaz líquido-aire quede saturada, cualquier exceso que se añada hará que aumente la cantidad de moléculas de tensioactivos en el medio líquido.
Dado que los tensioactivos son moléculas que presentan dos regiones bien diferenciadas, la cola apolar y la cabeza polar, es de esperar que estas colas apolares presenten dificultades en el medio acuoso, ya que, al fin y al cabo, esta parte de las moléculas tensioactivas no es soluble.
Finalmente, cuando la cantidad de moléculas tensioactivas dispersas en el líquido alcanza un valor determinado, que es lo que llamamos concentración micelar crítica (CMC), hay suficientes moléculas tensioactivas dispersas en el líquido para que comiencen a encontrarse y organizarse de manera que protejan sus colas apolares del contacto con el agua.
En general, los tensioactivos necesitan entre 30 y 200 moléculas para que se forme una micela que proteja eficazmente las colas apolares. Esto puede parecer mucho, pero en términos moleculares es una cantidad minúscula. Además, para que haya una posibilidad real de que se formen estas micelas, no conviene pensar en el número de moléculas: lo correcto es pensar en la concentración de tensioactivo, es decir, cuántas moléculas de tensioactivo hay para la masa líquida.
Por lo tanto, aunque una micela necesita entre 30 y 200 moléculas de tensioactivo para formarse, en términos de concentración, la mayoría de los tensioactivos deben estar presentes en una concentración de hasta el 1 % para que se inicie el fenómeno de formación de micelas.
A continuación, comentaremos brevemente el comportamiento de las medidas de tensión superficial en relación con la concentración de tensioactivos en el medio, evaluando brevemente esta concentración micelar crítica desde otro punto de vista.
Pero, ¿qué relación hay entre los tensioactivos y la tensión superficial del agua?
Dado que la tensión superficial está directamente relacionada con la atracción que generan las moléculas entre sí, con la introducción de tensioactivos, que tienen regiones polares y apolares, la fuerza de atracción entre las moléculas de agua disminuirá, ya que se enfrentarán a «intrusos» que reducen su fuerza. Por lo tanto, cuanto más tensioactivo se añada a una solución acuosa, menor será la tensión superficial de esta solución.
Sin embargo, esta disminución de la tensión superficial no es infinita: la tensión superficial mínima de una solución acuosa se alcanza cuando la CMC del tensioactivo está presente en el medio. A partir de esta concentración, cualquier adición de tensioactivo ya no reducirá la tensión superficial de la solución acuosa.

¿Quiere saber más sobre los tensioactivos y sus aplicaciones? ¿Necesita ayuda para elegir el tensioactivo ideal para cada aplicación? ¿Le gustaría evaluar los efectos de una combinación de diferentes tensioactivos?
El SmartLab de Macler está a su disposición para ayudarle en todas estas cuestiones. Nuestros especialistas combinan conocimientos técnicos y resultados prácticos, lo que puede ayudar a su empresa en todas las etapas del desarrollo de su producto.
Póngase en contacto con nosotros y hable con un especialista.

Lee también
Quizás uno de los productos químicos más conocidos y utilizados por los consumidores brasileños, y que influye drásticamente en la cultura y el comportamiento en lo que respecta a la limpieza, es el hipoclorito de sodio, el famoso "cloro.
Cuando la temperatura cambia, pueden surgir turbidez, separación de fases, formación de cristales o alteraciones en la viscosidad. Dos parámetros son especialmente importantes en este análisis: el punto de niebla y el punto de enturbiamiento.
Nuestra quimica
Usamos nuestro laboratorio para crear soluciones
químicas inteligentes en equilibrio con su realidad.
Productos
Utilizamos nuestro centro de I+D, un laboratorio interno con profesionales experimentados, para ofrecer soluciones químicas inteligentes en equilibrio con su realidad.